Härgade trombolüütikumide kasutamise üldpõhimõtted. Äge koronaarsündroom Aldosterooni retseptori blokaatorid
Märksõnad:äge koronaarsündroom, tromboosivastased ained, trombotsüütide vastased ained
SISSEJUHATUS JA MÕISTED.
Ebastabiilne stenokardia ja müokardiinfarkt - vormid isheemiline haigus südamed nõudlikud erakorraline abi ennetada ohtlikke tüsistusi, sh. surmav. Tavaliselt, kuigi mitte alati, on nende seisundite põhjuseks aterosklerootilise naastu rebend või endoteeli erosioon, millele järgneb tromboos. koronaararter ja ägeda isheemia areng. Nagu paljud uuringud on näidanud, algas varasem vajalik ravi, seda suurem on lootus soodsale prognoosile konkreetsel patsiendil. Seetõttu pööratakse erilist tähelepanu ägeda müokardiisheemia varajasele äratundmisele, mis on äärmiselt oluline läbi viia juba patsiendi esmase läbivaatuse staadiumis. Sel eesmärgil võeti kasutusele termin "äge koronaarsündroom" (ACS).
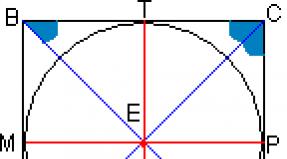
Niisiis, OKS - mis tahes kombinatsioon kliinilised sümptomid või müokardiinfarktile (MI) või ebastabiilsele stenokardiale (HC) viitavad nähud. Hõlmab MI (püsiva ST elevatsiooniga või ilma püsiva ST elevatsioonita, diagnoositud ensüümide või biomarkerite muutuste, hiliste EKG märkide järgi) ja NS (joonis 1).
Mõiste OKS võeti kasutusele seoses:
· vajadusega alustada ravi enne loetletud seisundite lõpliku diagnoosi kindlaksmääramist;
Kasutatakse patsientide tähistamiseks esimesel kokkupuutel nendega ja
· Viitab nende kui MI või NA-ga patsientide ravi vajadusele.
Kuna diagnoosimise esialgses staadiumis ei ole alati võimalik eristada NA-d ja MI-d, aga ka muid sarnase kliinikuga haigusi, on patsiendi erakorralises hospitaliseerimises soovitatav eeldiagnoosina välja tuua TÕENÄOLIK ACS, ja PROPPEKTSIOONILINE ACS kui sekundaarne diagnoos juhul, kui on tõenäolisem, et ravi põhjuseks on mõni muu haigus, kuid ACS pole veel välistatud.
Äge müokardi isheemia võib olla märk arenevast müokardiinfarktist (koos Q-laine moodustumisega või ilma), kuid see ei tähenda alati kardiomüotsüütide nekroosi (ebastabiilne stenokardia).
Kliinilisest vaatenurgast on oluline eristada EKG-s püsiva ST-segmendi elevatsiooniga ACS-i ja püsiva ST-segmendi elevatsioonita ACS-i (joonis 1).
Haige stabiilse ST tõusuga ACS-ga- need on patsiendid, kellel on valu või ebamugavustunne rinnus ja ST-segmendi püsiv tõus või "uus" (uus või eeldatavasti uus) täielik vasaku kimbu blokaad EKG-s. ST-segmendi püsiv tõus viitab koronaararteri ägedale täielikule oklusioonile trombi poolt. Sellises olukorras ravi peamine ülesanne on veresoone valendiku kiire ja stabiilne taastamine (reoklusioon). Selleks kasutatakse trombolüütilisi aineid (vastunäidustuste puudumisel) või otsest angioplastiat (perkutaanne koronaarne sekkumine - PCI). ST elevatsiooniga ACS näitab MI (ST elevation MI) arengut
Haige ACS-iga ilma stabiilse ST tõusuta- need on patsiendid, kellel on valu või ebamugavustunne rinnus ja EKG muutused, mis viitavad ägedale müokardiisheemiale, kuid ilma ST-segmendi tõusuta. Nendel patsientidel võib esineda püsiv või mööduv ST depressioon, inversioon, lamenemine või T-laine pseudonormaliseerumine, kuigi mõnel patsiendil võib vastuvõtul olla normaalne EKG. Tõestamata efektiivsuse tõttu ei kasutata selliste patsientide ravis trombolüütilisi aineid. Ravi põhieesmärgid on koronaararteri avatuse säilitamine, piirates ja ennetades intrakoronaarse trombi moodustumist ja distaalset trombembooliat, kõrvaldades isheemia (konservatiivne või operatiivne - PCI). ACS ilma ST elevatsioonita võib põhjustada NA või MI (MI ilma ST elevatsioonita). Soovitatav on anda loetletud kliiniliste vormide täpsed määratlused.
1. pilt
ÄGEDE KOONAARSÜNDROOMIDE KLASSIFIKATSIOON JA KÄIK
Müokardiinfarkt (äge, arenev või hiljutine) kliiniliste tunnuste järgi tehakse kindlaks tüüpilised muutused biokeemilised markerid müokardi nekroos(troponiini taseme tõus ja järkjärguline langus või CPK-MB taseme kiirem tõus ja langus) koos vähemalt ühe järgmistest nähtudest:
a) isheemilised sümptomid;
b) ebanormaalsete Q-lainete tekkimine EKG-s;
(c) EKG muutused, mis viitavad isheemiale (ST elevatsioon või depressioon, T muutused);
d) koronaararterite sekkumised (PCI).
STEMI püsiva ST elevatsiooniga (STEMI)- "uus" või oletatavasti "uus" püsiv ST-kõrgus kahes või enamas kõrvuti asetsevas juhtmes J-punkti tasemel 0,2 mV (2 mm) või rohkem juhtmetes V1, V2 või V3 või 0,1 mV (1 mm) teistes juhtmetes (koos tüüpiliste muutustega nekroosimarkerites).
MI ilma püsiva ST elevatsioonita (IMBP ST)- "uus" või arvatavasti "uus" ST-segmendi depressioon või ainult T-laine muutused (sümmeetriline inversioon 0,1 mV või rohkem) kahes või enamas kõrvuti asetsevas juhtmes kombinatsioonis isheemilised sümptomid retrosternaalse ebamugavustunde (valu) või kliiniliste ekvivalentide kujul:
- "põhjuseta" iiveldus, oksendamine;
- vasaku vatsakese puudulikkusega kaasnev püsiv õhupuudus;
- "põhjuseta" nõrkus, pearinglus või minestus.
Nende sümptomite kombinatsioon tüüpiliste muutustega nekroosimarkerites on kohustuslik.
Mõisteid STEMI ja STEMI kasutatakse ajutiselt kuni müokardiinfarkti lõpliku määratluseni (koos Q-laine moodustumisega või ilma, määratlemata tüüp)
Ebastabiilne stenokardia erinevalt STEMI-st ei kaasne sellega olulisi muutusi müokardi nekroosi markerites. See pakub:
Stenokardia, mis esineb rahuolekus ja pikaajaline (tavaliselt rohkem kui 20 minutit);
- esmakordselt tekkiv stenokardia vähemalt 3 FC tasemel;
- progresseeruv stenokardia amplifikatsiooni vormis 1 FC-lt vähemalt 3 FC-ni.
Nagu teate, eeldab ACS-i patsientide ravi kaasaegne taktika varajase kirurgilise sekkumise võimalust, eriti patsientidel, kellel on suur risk ebasoodsa tulemuse tekkeks. Kuid tänapäeval on Venemaal vaid piiratud arv suuri meditsiinikeskused on võimeline tegema kiireloomulisi sekkumisi koronaararterites (PCI, CABG). Seetõttu on enamiku patsientide jaoks piisav konservatiivne ravi ainus võimalik ravivõimalus.
ACS-ravi eesmärk on kõrvaldada isheemia ja selle tüsistused, vältida müokardi nekroosi (või selle edasise leviku) teket, parandada ja stabiliseerida koronaarset verevoolu ning lõppkokkuvõttes parandada patsientide prognoosi.
Tuginedes ACS-i patogeneesi ühisosale, tuleks kaaluda nende ravimteraapia põhisuundi:
· Koronaararterit ummistava verehüübe lüüs (ST elevatsiooniga ACS puhul);
· Trombi edasise moodustumise, mikroembolisatsiooni ja tingimuste loomine trombi spontaanseks lüüsiks, mis ei sulge veresoone valendikku;
· Isheemia kõrvaldamine ja selle esinemise ennetamine;
Sümptomaatiline ravi (valu vaigistamine, südamepuudulikkuse, šoki, arütmiate jne ravi)
Müokardiinfarkti sekundaarse ennetamise meetmete algatamine
Peamised rühmad farmakoloogilised ained ACS-i ravis kasutatavad antitrombootilised ained, stenokardiavastased ained, aga ka teiste rühmade ravimid.
ACS-I RAVIKS KASUTATAVAD RAVIMID:
1. Tromboosivastased ained:
2. Stenokardiavastased ravimid:
3. Muud fondid:
AKTI RAVIS KASUTATAVATE FARMAKOLOOGILISTE AINETE PÕHIRÜHMADE OMADUSED
Antitrombootilised ained
Antitrombootilised ained on ette nähtud trombide tekke vältimiseks või piiramiseks, samuti tekkiva trombi hävitamiseks. Need võib jagada 3 suurde rühma: trombotsüütide agregatsiooni tõkestavad ained, antikoagulandid ja trombolüütikumid. Enne iga rühma ravimite toime rakenduspunktide puudutamist on vaja lühidalt peatuda vere hüübimise peamistel etappidel ja mehhanismidel.
Hemostaas toimub vaskulaarsete, trombotsüütide ja plasmafaktorite reguleeritud koostoime kaudu (joonis 2.).
Hemostaasi vaskulaarne komponent aitab vähendada verejooksu kahjustatud veresoonest selle kokkutõmbumise ja kokkusurumise tõttu väljavoolava vere poolt, kuid mis on eriti oluline, kollageeni ja koe tromboplastiinirikka subendoteliaalse kihi eksponeerimine käivitab hüübimisreaktsioonide kaskaadi. .
Hemostaasi trombotsüütide komponent tagab trombotsüütide trombide kiire moodustumise veresoonte kahjustuse kohas. Lisaks eritavad trombotsüüdid vasokonstriktoreid ja nende membraanid pakuvad pinna- ja fosfolipiidkomponente ensüümi-kofaktori komplekside moodustumiseks koagulatsiooni järgmises etapis. Plasma hüübimisfaktorite koostoime viib trombi moodustumise lõpule, tugevdades seda fibriini niitidega. Tüüpiline arteriaalne intrakoronaarne stenoseeriv tromb koosneb valgest peast (trombotsüütide tromb endoteeli kahjustuse kohas) ja punasest sabast, mis on põhjustatud vere staasist.
Trombotsüütide hemostaas sisaldab 2 etappi: trombotsüütide adhesioon (adhesioon) veresoone seina avatud kollageeniga (läbi von Willebrandi faktori, kasutades retseptoreid Ib, samuti retseptoreid Ia) ja nende järgnevat agregatsiooni (IIb ja IIIa trombotsüütide retseptorite sidumise kaudu). fibrinogeeni ja teiste kleepuvate valkude molekulidega). Kõige võimsamad agregatsiooni stimulaatorid on tromboksaan A 2 ja ADP, mida eritavad vereliistakud ise nende membraanide interaktsiooni tulemusena kollageeni ja trombiiniga. Tromboksaan A2 sünteesitakse arahhidoonhappest ensüümi tsüklooksügenaasi abil (inhibeerib aspiriin).
Koagulatsiooni "plasma" staadiumi saab käivitada kahel viisil: sisemise mehhanismi abil, mis aktiveeritakse vere sisemiste hüübimisfaktorite poolt kokkupuutel negatiivselt laetud trombotsüütide pinnaga, ja välise mehhanismi abil, mida aktiveerib koe tromboplastiin, mis ilmneb veres. ringlev veri ainult siis, kui veresoon on kahjustatud.
2. pilt
PEAMISED TROMBOOTIVASTASTE AINETE MÕJU KASUTAMISE PÕHIMÕISTED

Alternatiivsetes verehüübimisteedes on levinud tegur X aktiveerimine. Viimane koos aktiveeritud faktori V, prokoagulandi fosfolipiidi ja Ca 2+ ioonidega põhjustab trombotsüütide pinnal protrombiini konversiooni trombiiniks (faktor II), mis omakorda muudab fibrinogeeni fibriiniks (faktor I) ja aktiveerib fibriini stabiliseeriva faktori (faktor XIII).
Sisemise hüübimisraja korral aktiveerub faktor X XII (kõrge molekulmassiga kininogeeni ja prekallikreiini juuresolekul), XI ja IX faktorite järjestikuse aktiveerimise kaudu kompleksi toimel, mis koosneb aktiveeritud faktoritest IX, VIII, prokoagulandi fosfolipiidist ja kaltsiumiioonid. Kell välistee hüübimisfaktor X muutub aktiivseks aktiveeritud VII faktori toimel kombinatsioonis koe tromboplastiiniga.
Plasma hüübimisinhibiitorid on: koefaktori raja inhibiitor - TFPI (inhibeerib Xa, samuti kompleksi VIIa + koe tromboplastiini), anti-trombiin III (inhibeerib trombiini, Xa ja IXa faktoreid), proteiin C (inaktiveerib faktoreid Va ja VIIIa ), proteiin S ja trombomoduliin, samuti hepariinitaolised ühendid, mis koos trombiini ja antitrombiin III-ga suurendavad viimase aktiivsust. Fibriini lagunemissaadused (lahustuv fibriin, fibriini-monomeeri kompleksid) omavad ka trombiinivastast toimet.
Veresoonte avatuse taastamiseks eemaldab fibrinolüütiline süsteem liigsed fibriinihüübed.
Koronaararterite ateroskleroosi areng ja progresseerumine on tihedalt seotud tromboosiga. On teada, et trombootilise arteri oklusioon areneb ainult aterosklerootilise naastu piirkonnas (tavaliselt selle rebenemise või dissektsiooni tõttu). Seetõttu on tromboosivastased ained IHD tüsistuste ennetamisel ja ravis üks keskseid kohti.
Trombotsüütidevastased ained (trombotsüütide vastased ained)
Kogutud andmed näitavad, et trombotsüütide roll koronaararterite haiguse patogeneesis ei piirdu ainult intrakoronaarse trombi moodustumisega. On teada, et trombotsüüdid osalevad aterosklerootilise naastu enda arengus, stimuleerides silelihasrakkude proliferatsiooni (trombotsüütide kasvufaktor), samuti intramuraalsete trombide teket. Seetõttu on trombotsüütide vastased ained vajalikud mitte ainult intravaskulaarse tromboosi vältimiseks, vaid ka ateroskleroosi progresseerumise aeglustamiseks. Need ravimid on osutunud tõhusaks nii koronaararterite kui ka aju- ja perifeersete arterite mõjutamisel. Need vahendid vähendavad trombotsüütide funktsionaalset aktiivsust, ennekõike nende võimet agregeerida. Agregatsiooniblokaadi saab saavutada tromboksaan A2 (aspiriin), ADP (tienopüridiinide) toime pärssimisega või trombotsüütide glükoproteiini retseptorite IIb / IIIa enda neutraliseerimisega (absiximab jne).
PLAADIVASTASED AINED (ANTI-AGREGANTS):
Arahhidoonhappe metabolismi inhibiitorid:
1) tsüklooksügenaasi inhibiitorid:
atsetüülsalitsüülhape (ASA), indobufeen, triflusal
2) tromboksaani blokaatorid:
pikotamiid, ridogreel, vapiprost
Ravimid, mis suurendavad cAMP sisaldust trombotsüütides:
1) trombotsüütide PDE inhibiitorid
dipüridamool, triflusal
2) adenülaattsüklaasi stimulandid
iloprost
ADP retseptori blokaatorid (tienopüridiinid):
Tiklopidiin; klopidogreel
Trombotsüütide glükoproteiini retseptorite IIb / IIIa antagonistid:
Abtsiksimab; eptifibatiid, tirofibaan, lamifibaan
V kompleksne ravi ACS kasutab aktiivselt ainult piiratud loendit trombotsüütide agregatsiooni vastastest ainetest: see on tsüklooksügenaasi inhibiitor - atsetüülsalitsüülhape, ADP-retseptori blokaatorid tienopüridiinid - klopidogreel ja tiklopidiin, samuti IIb / IIIa glükoproteiini retseptorite antagonistid - astsiksimab ja eptifibaan.
Dipüridamool ja prostatsükliini analoogid olid ACS-i ravis ebaefektiivsed ja tromboksaani blokaatorid ei näidanud aspiriini ees mingeid eeliseid.
Soovitatav on anda mõned põhimõtted trombotsüütidevastaste ravimite kasutamiseks ACS-is:
· Trombotsüütidevastased ained – ägedate koronaarsündroomide ravi nurgakivi ja seetõttu ravi asendamatu komponent;
Need tuleb välja kirjutada võimalikult varakult, samal ajal kui ravi algab küllastusannustega;
· Aspiriin määratakse vastunäidustuste puudumisel kõigile ACS-ga patsientidele; aspiriini talumatuse korral asendada see klopidogreeliga;
· Trombotsüütidevastased ained kombineeritakse reeglina hepariini või selle madala molekulmassiga fraktsioonide sisseviimisega;
Konservatiivse ACS-i kasutuselevõtu taktikaga on soovitatav kombineerida erinevate toimemehhanismidega trombotsüütidevastaseid aineid, kuigi see on seotud hemorraagiliste tüsistuste suure riskiga;
Trombotsüütidevastase ravi aktiivsuse määrab patsiendi prognoosi raskus koos kohustusliku registreerimisega võimalik risk verejooks.
Atsetüülsalitsüülhape (Aspiriin, Akupriin, Ecotrin, Plidol, Bufferin; enteraalsed vormid - Aspirin Cardio ja Thrombotic ACC; intravenoosseks manustamiseks - Aspirin-DL-lüsiin).
Farmakodünaamika: Atsetüülsalitsüülhape (ASA) pärsib kudedes ja trombotsüütides tsüklooksügenaasi, mis blokeerib tromboksaan A2 moodustumist, mis on üks peamisi trombotsüütide agregatsiooni indutseerijaid. Trombotsüütide tsüklooksügenaasi blokaad on pöördumatu ja püsib kogu trombotsüütide eluea jooksul, s.o. 7-10 päeva, mis põhjustab märkimisväärse toime kestuse, mis püsib ka pärast ravimi eemaldamist organismist. Annustes üle 300 mg päevas inhibeerib ASA trombotsüütide agregatsiooni vastase aine ja vasodilataatori prostatsükliini tootmist endoteeli poolt, mis on üks lisapõhjuseid ravimi väiksemate annuste (75-160 mg päevas) kasutamisel trombotsüütide agregatsioonivastase ainena. . Aspiriini annused alla 75 mg on tõenäoliselt vähem tõhusad ja annused üle 160 mg päevas suurendavad verejooksu riski.
ASA toime algab 5 minuti jooksul pärast allaneelamist ja saavutab maksimumi 30-60 minutiga, püsides stabiilsena järgmise 24 tunni jooksul Trombotsüütide funktsionaalse seisundi taastamiseks on vajalik vähemalt 72 tundi pärast ühekordse ASA annuse manustamist.
Aspiriin vähendab müokardiinfarkti ja sellest põhjustatud surmajuhtumeid kardiovaskulaarsed põhjused NS-ga patsientidel, seetõttu määratakse vastunäidustuste puudumisel aspiriin kõigile ACS-i kahtlusega patsientidele. Aspiriini jätkuva võtmisega pärast patsiendi seisundi stabiliseerumist saavutatakse pikaajaline profülaktiline toime.
Farmakokineetika: ASA biosaadavus suukaudsel manustamisel on 50–68%, maksimaalne plasmakontsentratsioon saavutatakse 15–25 minuti pärast (prolongeeritud vabanemisega enteraalsete vormide puhul 4–6 tundi). Imendumisel metaboliseerub ASA osaliselt maksas ja soolestikus, moodustades salitsüülhappe, nõrgema trombotsüütide agregatsiooni. Seetõttu näritakse kiireloomulises olukorras biosaadavuse suurendamiseks ja toime avaldumise kiirendamiseks esimene ASA tablett suus, mis tagab ravimi imendumise süsteemsesse vereringesse, möödudes maksast. ASA poolväärtusaeg on 15-20 minutit, salitsüülhape - 2-3 tundi ASA eritumine toimub vaba salitsüülhappe kujul neerude kaudu.
Näidustused: ACS-ravi; müokardiinfarkti sekundaarne ennetamine; tromboosi ja reoklusiooni ennetamine pärast CABG-d, PCI-d, perifeersete arterite plastika; trombemboolia ennetamine aastal krooniline vorm kodade virvendusarütmia, pärast südameklappide proteesimist, mööduva ajuisheemiaga, perifeersete veresoonte haigusega.
Vastunäidustused: ASA talumatus, raske allergia bronhospasmi rünnakute kujul (sealhulgas bronhiaalastma koos rinosinusopaatiaga - "aspiriini astma"); hemofiilia ja trombotsütopeenia; aktiivne verejooks, sh. võrkkesta hemorraagia; erosiivsed ja haavandilised protsessid seedetrakti või muud seedetrakti verejooksu allikad või kuseteede; raske kontrollimatu hüpertensioon; raske neeru- ja maksakahjustus.
Taotlus ACS-i jaoks: kui patsient ei ole enne vastuvõtmist ASA-d võtnud, tuleb esimene annus ravimit (325-500 mg) närida suus (kasutades tavalist, mitte enteraalset aspiriini). Säilitusannus on 75-162 mg (võib kasutada enterovorme) üks kord päevas pärast sööki. Uuringutes, mis on tõestanud aspiriini positiivset toimet ACS-i korral, on kasutatud peamiselt ravimi "lihtsaid" (mitteenteraalseid) vorme. ASA enteraalsete vormide eeliseid tavapäraste vormide ees hemorraagiliste tüsistuste esinemissageduse osas ei ole tõestatud.
On märke, et mõned patsiendid võivad olla aspiriini suhtes resistentsed, kuigi selle seisundi kontrollimiseks puuduvad usaldusväärsed kliinilised testid. Patsientidel, kellel on kõrge trombootiliste tüsistuste risk, on vaja ASA-d täiendada teiste trombotsüütide vastaste ainetega (klopidogreel, trombotsüütide glükoproteiini IIb / IIIa retseptori antagonistid).
Kõrvalmõjud: verejooks, düspepsia ning söögitoru-gastroduodenaalse tsooni erosiivsed ja haavandilised kahjustused, bronhospasm, äge podagrahoog, mis on tingitud uraadi eritumise häiretest, allergilised reaktsioonid.
Koostoimed ravimitega: antihüpertensiivsete ja diureetikumide toime nõrgenemine, verejooksu riski suurenemine, kui seda manustatakse koos kaudsed antikoagulandid, muud MSPVA-d, hüpoglükeemiliste ainete toime võimendamine jne.
Tiklopidiin (Tiklid, Tiklin)
Farmakodünaamika: Tienopüridiini rühma kuuluv ravim tiklopidiin blokeerib ADP-retseptoreid trombotsüütide membraanidel, inhibeerides agregatsiooni ja degranulatsiooni. Ravim suurendab lämmastikoksiidi moodustumist endoteelirakkude poolt, vähendab vere viskoossust.
Suurte uuringute kohaselt vähendab tiklopidiin tüsistuste riski patsientidel pärast PCI-d stentimisega, samuti vaskulaarsete tüsistuste esinemissagedust ajuveresoonkonna haigustega patsientidel. Ravim on efektiivne veresoonte hävitavate haiguste ravis. alajäsemed ja glomerulonefriidiga patsientidel suurendab see kreatiniini kliirensit ja vähendab proteinuuria raskust.
Tiklopidiini toime algab aeglaselt, 1-2 päeva pärast manustamist, toime tipp langeb 3-6 ravipäeval ja toime kestus ulatub 4-10 päevani. Seetõttu ei ole see ravim "esimese valiku" ravim ACS-i raviks.
Farmakokineetika: Tiklopidiini biosaadavus on 80-90% (suureneb pärast sööki võtmisel) ja maksimaalne plasmakontsentratsioon saavutatakse 2 tunni pärast.Poolväärtusaeg pärast esimese annuse võtmist on 12-13 tundi, see pikeneb 4-5 päevani. tavaliste ravimitega. Ravimi stabiilne kontsentratsioon plasmas luuakse 2-3 ravinädalal. Ravimi metabolism toimub maksas, metaboliitide eritumine toimub uriiniga, osa ravimist eritub muutumatul kujul sapiga.
Näidustused: müokardiinfarkti sekundaarne ennetamine; tromboosi ja reoklusiooni ennetamine pärast PCI-d, CABG-d; ACS-ravi; insuldi ennetamine mööduva ajuisheemiaga patsientidel; tromboosi ennetamine perifeersete arterite hävitavate haiguste korral.
Vastunäidustused: hemorraagiline diatees; hematoloogilised häired: neutropeenia, agranulotsütoos, trombotsütopeenia; seedetrakti verejooks, intrakraniaalne hemorraagia (ja anamneesis); raske maksapuudulikkus; vanus alla 18 aasta; rasedus ja imetamine; ülitundlikkus ravimi suhtes.
Taotlus ACS-i jaoks: 250 mg 2 korda päevas pärast sööki. Kell neerupuudulikkus Tiklopidiini annust vähendatakse. ASA-ga koosmanustamine nõuab suurt ettevaatust suure verejooksuriski tõttu. Esimesel 3 ravikuul tehakse kord 2 nädala jooksul vereanalüüs moodustunud elementide loendamisega, sh. trombotsüüdid.
Kõrvalmõjud: esinevad pooltel patsientidest, see on düspepsia (30-40%), verejooks (ravim tühistatakse 10-14 päeva enne plaanilist operatsiooni), neutropeenia (2,5%), agranulotsütoos (0,8%) ja trombotsütopeenia esimese 3 kuu jooksul. ravi (palavik, kurguvalu, aftoosne stomatiit, purpur), maksafunktsiooni häired, hemolüüs, pearinglus, peavalu, tinnitus.
Klopidogreel (Plavix)
Farmakodünaamika: Tienopüridiini rühma esindaja klopidogreel pärsib trombotsüütide agregatsiooni nende ADP retseptorite pöördumatu ja selektiivse blokeerimisega.
Trombotsüütide vastane toime areneb 2 tundi pärast ravimi küllastusannuse võtmist (agregatsiooni vähenemine 40%). Maksimaalne toime (60% agregatsiooni pärssimine) saavutatakse ravimi säilitusannuse pideva manustamise 4.-7. päeval ja kestab 7-10 päeva (trombotsüütide eluiga).
Suure uuringu CAPRIE kohaselt on klopidogreel sama efektiivne kui aspiriin ja võib-olla isegi veidi tõhusam MI, isheemilise insuldi ja vaskulaarsetest põhjustest põhjustatud surma sekundaarses ennetamises.
Võrreldes tiklopidiiniga, on toime kiirem ja taluvus parem (harvemini hematoloogilised ja düspeptilised tüsistused), seetõttu on ACS-i raviks eelistatav klopidogreel.
Klopidogreeli kombinatsioon ASH-ga on ohutum kui ASH ja tiklopidiini kombinatsioon, kuigi verejooksu risk siiski suureneb. Siiski on klopidogreeli ja aspiriini samaaegne manustamine ST-tõusuta ACS-i ravis efektiivsem kui aspiriin üksi. Lisaks parandab ravim kombinatsioonis aspiriiniga oluliselt PCI tulemusi.
Farmakokineetika: Ravimi biosaadavus on kõrge, maksimaalne plasmakontsentratsioon tekib 1 tunni pärast Klopidogreel on eelravim, selle metaboliit on aktiivne pärast biotransformatsiooni maksas. Poolväärtusaeg on 8 tundi Ravim eritub uriini ja väljaheitega.
Näidustused: ACS-ravi; MI, insuldi, perifeersete arterite tromboosi sekundaarne ennetamine; tromboosi ja reoklusiooni ennetamine pärast PCI-d.
Vastunäidustused: individuaalne sallimatus; aktiivne verejooks; erosiivsed ja haavandilised protsessid seedetraktis; raske maksapuudulikkus; vanus alla 18 aasta.
Taotlus ACS-i jaoks: kui patsient ei võtnud klopidogreeli enne vastuvõttu, on ravimi esimene annus 300 mg (4 tabletti) suukaudselt üks kord (küllastusannus), siis päevane säilitusannus 75 mg (1 tablett) üks kord päevas, sõltumata toidust. tarbimine 1 kuni 9 kuud
Kui patsient kavatseb teha CABG-d (kuid mitte PCI-d), ei määrata klopidogreeli või see tühistatakse 5 ja eelistatavalt 7 päeva enne operatsiooni, et vältida ohtlikku verejooksu.
Kõrvalmõjud: düspepsia ja kõhulahtisus, seedetrakti verejooks, intrakraniaalne hemorraagia, neutropeenia (peamiselt esimese 2 ravinädala jooksul), nahalööve.
Ravimite koostoimed: suurenenud verejooksu risk, kui seda määratakse koos ASA ja MSPVA-dega
Abtsiksimab (Abtsiximab, ReoPro)
Farmakodünaamika: Abtsiksimab (AB) on trombotsüütide glükoproteiini IIb / IIIa retseptorite antagonistide rühma esindaja. IIb / IIIa retseptorid (alfa IIb beeta 3 integriinid) asuvad trombotsüütide pinnal. Trombotsüütide aktivatsiooni tulemusena muutub nende retseptorite konfiguratsioon, mis suurendab nende võimet fikseerida fibrinogeeni ja teisi kleepuvaid valke. Fibrinogeeni molekulide seondumine erinevate trombotsüütide IIb / IIIa retseptoritega viib plaatide ühendamiseni üksteisega - agregatsioonini. See protsess ei sõltu aktivaatori tüübist ja on viimane ja ainus trombotsüütide agregatsiooni mehhanism.
AB- Kimäärsete inimese-hiire monoklonaalsete antikehade 7E3 Fab-fragment on kõrge afiinsusega IIb / IIIa glükoproteiini trombotsüütide retseptorite suhtes ja seondub nendega pikka aega (kuni 10-14 päeva). Rohkem kui 80% retseptorite blokeerimise tulemusena on trombotsüütide agregatsioon viimases etapis häiritud. Pärast ravimi manustamise lõpetamist taastub järk-järgult (1-2 päeva jooksul) trombotsüütide agregatsioonivõime.
AB on mittespetsiifiline ligand; see blokeerib ka endoteeli vitronektiini retseptoreid, mis osalevad endoteeli- ja silelihasrakkude migratsioonis, samuti Mac-1 retseptoreid aktiveeritud monotsüütidel ja neutrofiilidel. Nende mõjude kliiniline tähtsus ei ole siiski veel selge. Antikehade olemasolu AB või selle trombotsüütide retseptoriga kompleksi vastu võib põhjustada anafülaksiat ja ohtlikku trombotsütopeeniat.
Tõestatud on ravimi võime oluliselt parandada prognoosi PCI-ga patsientidel, eelkõige ACS-ga patsientidel, samuti patsientidel, kellel on kõrge kardiovaskulaarsete tüsistuste risk.
Aku kasutegur juures konservatiivne ravi ACS ei ole tõestatud (erinevalt eptifibatiidist ja tirofibaanist). Uuritakse ravimi ja teiste glükoproteiin IIb / IIIa retseptorite antagonistide kombineerimise võimalusi trombolüütikumidega ST-elevatsiooniga ACS-i ravis.
Farmakokineetika: Intravenoosse manustamise korral säilib AB stabiilne kontsentratsioon ainult pideva infusiooniga, pärast selle lõpetamist väheneb see kiiresti 6 tunni jooksul ja seejärel aeglaselt (10–14 päeva jooksul) trombotsüütidega seotud ravimifraktsiooni tõttu. Ravimi eritumine toimub uriiniga.
Näidustused: Tromboosi ja reoklusiooni ennetamine seoses PCI-ga (sealhulgas stendi paigaldamine) ACS-ga patsientidel (ST-segmendi elevatsiooniga ja ilma), samuti kõrge riskiga patsientidel.
Vastunäidustused: Sisemine verejooks; anamneesis seedetrakti verejooks (viimase 6 nädala jooksul); tserebrovaskulaarne õnnetus (sealhulgas anamneesis 2 aasta jooksul või märkimisväärsete jääknähtude olemasolul neuroloogilised ilmingud); intrakraniaalne neoplasm; varasemad hüübimishäired (hemorraagiline diatees, trombotsütopeenia
Taotlus ACS-i jaoks: IV boolus (10-60 minutit enne PCI-d) annuses 0,25 mg / kg, seejärel 0,125 mcg / kg / min (max 10 mcg / min) 12-24 tunni jooksul.
Ettevaatusabinõud. Ravim tuleb tõmmata süstlasse läbi 0,2-0,22 mikronilise filtri madal tase valkude sidumine, et vähendada valgulisandite olemasolust tingitud trombotsütopeenia tõenäosust. AB-d ei soovitata kasutada pärast angioplastikat, kui dekstraani süstiti pärast operatsiooni. Koagulatsioonikontroll viiakse alguses läbi iga 15-30 minuti järel angioplastika ajal ja iga 12 tunni järel kuni kateetrite eemaldamiseni. Hinnangulised parameetrid: aktiveeritud vere hüübimisaeg (300-350 s tasemel), hemoglobiinisisaldus, hematokrit, trombotsüütide arv.
Kõrvalmõjud: verejooks (sh intrakraniaalne, retroperitoneaalne), bradükardia, AV-blokaad, hüpotensioon, düspepsia (iiveldus, oksendamine), segasus, nägemiskahjustus, hüperimmuunreaktsioonid (trombotsütopeenia, aneemia, leukotsütoos, pleuraefusioon, pneumoniit, nahalööve, anafülaktiline šokk). Veritsusrisk on suurem üle 70-aastastel ja alla 70 kg kaaluvatel inimestel. Raske verejooksu ravi hõlmab trombotsüütide transfusiooni.
Eptifibatid (Integrilin)
Farmakodünaamika: Eptifibatiid (EP) on trombotsüütide glükoproteiini IIb/IIIa retseptorite blokeerija RGD mimeetikumide klassist. Põhimõtteliselt on toimemehhanism sarnane Ab omaga, kuid Ep on IIb / IIIa retseptorite suhtes selektiivne.
EP toime ilmneb kohe pärast intravenoosset manustamist annuses 180 μg / kg. Agregatsiooni pärssimine on pöörduv. 4 tundi pärast intravenoosse infusiooni lõpetamist annuses 2 μg / kg / min saavutab trombotsüütide funktsioon enam kui 50% algtasemest.
Erinevalt AB-st on ravim tõenäoliselt efektiivne ACS-i konservatiivses ravis.
Farmakokineetika: Soovitatavate annuste manustamisel on EP farmakokineetika lineaarne ja maksimaalne kontsentratsioon saavutatakse kiiresti. Valkudega seondumise määr on 25%. Poolväärtusaeg on 2,5 tundi Ravim eritub ligikaudu 50% ulatuses uriiniga.
Näidustused: Tromboosi ja reoklusiooni ennetamine seoses PCI-ga (sh stendi paigaldamisega); äge koronaarsündroom ilma ST elevatsioonita (kombinatsioonis ASA, UFH või LMWH-ga ja võimalik, et ka tiklopidiiniga).
Vastunäidustused: hemorraagiline diatees või raske patoloogiline verejooks järgmise 30 päeva jooksul; raske arteriaalne hüpertensioon (süstoolne vererõhk üle 200 mm Hg või diastoolne vererõhk üle 110 mm Hg) antihüpertensiivse ravi taustal; suuremad kirurgilised sekkumised viimase 6 nädala jooksul; insult viimase 30 päeva jooksul või anamneesis hemorraagiline insult; sõltuvus hemodialüüsist neerupuudulikkuse tõttu; teise trombotsüütide IIb / IIIa retseptorite inhibiitori samaaegne kasutamine parenteraalseks manustamiseks; ülitundlikkus ravimi suhtes.
Taotlus ACS-i jaoks: Intravenoosne boolusboolus annuses 180 mcg / kg 1-2 minuti jooksul, seejärel tilguti annuses 2 mcg / kg / min (seerumi kreatiniinitasemel kuni 2 mg / dl), annuses 1 mcg / kg / min (kreatiniini tasemel 2-4 mg / dl) 72 tundi või kuni tühjenemiseni. Vajadusel võib raviaega pikendada maksimaalselt 96 tunnini. Kui plaanitakse PCI-d, alustatakse ep manustamist vahetult enne operatsiooni ja jätkatakse vähemalt 12 tundi Aktiveeritud vere hüübimisaega tuleb kontrollida tasemel 200-300 s.
Kõrvalmõjud: enamasti verejooks.
Antikoagulandid
Antikoagulantravi eesmärk on inhibeerida plasma hüübimisfaktoreid, et vältida trombide teket või piirata nende levikut. Need ravimid hõlmavad otseseid ja kaudseid antikoagulante. Esimesed inhibeerivad otseselt trombiini ja teisi hüübimisfaktoreid, teised häirivad hüübimisfaktorite sünteesi, mille tulemusena kaotavad viimased oma aktiivsuse. Antikoagulandid on tõestanud oma efektiivsust nii venoosse kui ka arteriaalse tromboosi ja emboolia ennetamisel ja ravis, eriti ACS-i ravis.
KIRJANDUS
1) Põhi- ja kliiniline farmakoloogia / Under. toim. B.G. Katzunga. Per. inglise keelest toim. E.E. Zwartau: 2 köites. - M .: Binom - SPb .: Nevski murre, 1998. - T.2. - S.26-43.
2) Blizzard V.I. Viide jaoks kliiniline farmakoloogia kardiovaskulaarsed ravimid. - 2. väljaanne, Rev. ja lisage. - M .: Kirjastus BINOM - SPb .: Nevski murre, 2002 .-- 926 lk.
3) Venemaa ravimite register. Ravimite entsüklopeedia. M .: RLS, 2004 .-- 1497 lk.
6) V.V.Ruksin Erakorraline kardioloogia. - 4. väljaanne, Rev. ja lisage. SPb .: "Nevski murre", 2000. - 503 lk.
7) Vidali käsiraamat. Ravimid Venemaal: käsiraamat. M .: AstraFarmServis, 2003.- 1488 lk.
8) Alpert J.C. ja Thygesen K. et al. Müokardiinfarkt on uuesti defineeritud – Euroopa Kardioloogide Ühisühingu / Ameerika Kardioloogiakolledži komitee konsensusdokument müokardiinfarkti uuesti defineerimiseks. Euroopa Kardioloogia Ühisselts / Ameerika Kardioloogiakolledži komitee. // JACC. - 2000. - Kd.36, nr 3. - Lk.959-969.
9) Sipelgamees E.M. et al. ACC / AHA juhised ST-kõrgendusega müokardiinfarktiga patsientide ravimiseks. Kokkuvõte Ameerika Kardioloogiakolledži / American Heart Associationi töörühma aruanne praktikajuhiste kohta (kirjutamiskomitee 1999. aasta patsientide ravi juhiste muutmiseks Ägeda müokardiinfarktiga) // JACC. - 2004. - Vol. 44, nr 3. - Lk 671-719.
10) Bertrand M.E. et al. Ägedate koronaarsündroomide ravi patsientidel, kellel ei esine püsivat ST-segmendi tõusu. Euroopa Kardioloogide Seltsi ägedate koronaarsündroomide ravi töörühm. // Eur Südameajakiri. - 2002. - Vol.23. - Lk.1809-1840.
11) Braunwald E. jt. ACC / AHA juhised ebastabiilse stenokardia ja mitte-ST-segmendi elevatsiooniga müokardiinfarktiga patsientide raviks. Ameerika Kardioloogiakolledži / American Heart Association Task Force'i aruanne praktikasuuniste kohta (ebastabiilse stenokardiaga patsientide juhtimise komitee) // American College of Cardiology Journal. - 2000. -Kd. 36, nr. 3. - Lk 970-1062.
12) Braunwald E. jt. ACC / AHA 2002. aasta juhiste värskendus ebastabiilse stenokardia ja mitte ST-segmendi tõusuga müokardiinfarktiga patsientide raviks – kokkuvõte artikkel Ameerika Kardioloogiakolledži / American Heart Associationi töörühma aruanne praktikajuhiste kohta (patsientide juhtimise komitee) Ebastabiilse stenokardiaga) // JACC. - 2002. -Kd. 40, nr. 7. - Lk.1366-1374.
13) Ägedate koronaarsündroomide ravi: ägedad koronaarsündroomid ilma püsiva ST-segmendi tõusuta. Euroopa Kardioloogide Seltsi töörühma soovitused. // Eur Südameajakiri. - 2000. - Vol.21. - Lk 1406-1432.
Müokardi reperfusiooni hindamise "kuldstandard" on otsene koronaarangiograafia (CAG) koos antegraadse verevoolu hindamisega TIMI skaala järgi. Reaalses kliinilises praktikas toimub ST-segmendi elevatsiooniga müokardiinfarkti (MI) (STEMI) CAG ravi mitte trombolüütilise ravi (TLT) efektiivsuse rutiinse hindamise eesmärgil, vaid sekkumisstrateegia lahutamatu osana üldiselt. Teisest küljest määravad trombolüüsi õnnestumised või ebaõnnestumised konkreetse patsiendi kui terviku juhtimise edasise taktika: perkutaanse koronaarse sekkumise kiireloomulisus ja järjestus, ravimitoetus, täiendavate uuringute maht jne. Pakutakse välja mitteinvasiivsete (kaudsete) nähtude kohta, mis võimaldavad hinnata TLT efektiivsust otse patsiendi voodi kõrval. Olemasolevate kirjandusandmete kohaselt võib lõppenud reperfusiooni mitteinvasiivsed nähud jagada järgmistesse põhirühmadesse: kliiniline; elektrokardiograafiline; laboris. Samas on ilmne, et lõplik hinnang TLT tõhususe kohta tehakse olemasolevate funktsioonide terviku põhjal. Lõpetatud reperfusiooni kliinilised kriteeriumid hõlmavad valu lõplikku leevendust ja ägeda südamepuudulikkuse tunnuseid järgmise 30–60 minuti jooksul pärast trombolüüsi. Kliiniliste kriteeriumide hindamisel tuleb silmas pidada, et TLT on vaid üks STEMI kompleksse intensiivravi komponentidest, st patsiendi seisundi stabiliseerumine ei pruugi toimuda tänu efektiivsele reperfusioonile, vaid narkootilise aine kasutuselevõtu taustal. valuvaigistid, inotroopne tugi, perifeersete vasodilataatorite ja β-blokaatorite kasutamine. Seega on TLT efektiivsuse kliinilised kriteeriumid väga subjektiivsed ega tugine rangele tõendusbaasile. Müokardi reperfusiooni elektrokardiograafilised kriteeriumid on normaliseerumine või märkimisväärne, ≥ 50% algtasemest, ST-segmendi elevatsiooni langus võrreldes algtasemega 60–180 minuti jooksul pärast TLT-d. Lisaks on praktilise tähtsusega "uute" Q-lainete ilmumine EKG-le sama aja jooksul. Toimunud reperfusiooni uute EKG-kriteeriumide uurimine näib olevat enamiku ekspertide jaoks kõige lootustandvam suund.
Uurimisobjektiks on sellised EKG näitajad nagu ST-segmentide amplituudi summaarne langus kõigis infarktiga seotud juhtmetes; ST-segmendi amplituudi vähenemine pliis, kus registreeriti maksimaalne tõus; juhtmete arv, kus ilmusid "uued" Q-lained. EKG andmete kasutamine TLT efektiivsuse hindamiseks sai alguse ISAM uuringust (1986), kus teadlased leidsid seose ST-segmendi vähenemise astme EKG-l 3 tundi pärast trombolüüsi algust ja suremust. Aastal 1988 A. A. Smirnov jt. pakkus välja kaudse meetodi müokardi reperfusiooni hindamiseks, mis põhines ST-segmendi elevatsiooni vähenemise kiirusel. EKG indekseid hinnati 90 ja 180 minutit pärast trombolüüsi algust. ST-segmendi vähenemine rohkem kui 50% esikohal olevast esialgsest, maksimaalne tõus 3 tundi pärast TLT algust 92% tõenäosusega viitas tõhusale reperfusioonile koos verevoolu taastamisega läbi infarkti saanud koronaararteri (ISCA) TIMI skaalal 2-3. See kriteerium oli aluseks kaasaegsed juhised Venemaa Kardioloogide Selts TLT efektiivsuse hindamiseks. Uuringus HIT-4 (Hirudin for Improvement of Trombolysis Trial), mis hõlmas 1208 patsienti, kellel oli müokardiinfarkt, mille algusest ei kulunud rohkem kui 6 tundi ja kellele tehti süsteemne TLT, võrreldi languse astet. ST-segmendi elevatsioonis algtaseme suhtes 90 minutit pärast TLT algust KAG-i andmetega. Kui ST-segmendi elevatsiooni vähenemine isoliinini 90 minutit pärast TLT algust on ≥ 70% maksimaalse tõusuga juhtpositsiooni algtasemest, tehti ettepanek pidada sekkumist tõhusaks. Verevool ISKA-s vastas CAG andmetel TIMI 3-le 69% juhtudest. ST segmendi vähenemisega 70%-lt 30%-le peeti TLT efektiivsust kaheldavaks. ST-segmendi vähenemisega isoliinile alla 30% vastas verevool ISKA järgi 84% patsientidest TIMI 0-1-le.
R. Clemmensen et al. tegi ettepaneku võtta kokku ST segmendi tõusu amplituud kogu juhtivuse korral koos ST elevatsiooniga. Samal ajal korreleerus pärast trombolüüsi ST-segmendi elevatsiooni summaarse amplituudi langus 20% algväärtusest ISAA järgi verevoolu taastumisega TIMI 2-3 tasemel vastavalt angiograafia andmetele ja oli suurem. usaldusväärsem kriteerium kui ST segmendi absoluutse kõrvalekalde hindamine isoliini suhtes. Teine lähenemisviis on hinnata mitte ainult kogu tõusu, vaid ka kogu ST-segmendi depressiooni. AA Ševtšenko töös näidati, et ST-segmendi koguhälbe arvutamine kõigis juhtmetes, mitte ainult maksimaalse hälbega juhtmestikus, võimaldab täpsemalt määrata müokardi kahjustuse võimalikku mahtu ja ST-segmendi nihke dünaamika trombolüüsi ajal. ST-segmendi kogukõrguse vähenemist 50% või rohkem pärast 180 minuti möödumist TLT algusest loetakse TLT efektiivsuse kriteeriumiks, alla 50% - kui kahtlase tulemuse. Ebaefektiivse reperfusioonravi korral täheldati kogu ST-segmendi vähenemise suurenemist. Tõestus, et ST-segmendi summaarse elevatsiooni dünaamika on oluline TLT efektiivsuse kriteerium, samas kui efektiivse ja ebaefektiivse TLT-ga patsientidel ST-segmendi summaarse languse dünaamikas olulisi erinevusi ei esinenud. Mõnede autorite sõnul iseloomustab efektiivse TLT-ga erineva lokaliseerimisega infarkte ST-segmendi vähenemise erinev aste: eesmise lokaliseeritud STEMI korral on ST-segmendi elevatsiooni optimaalne vähenemise aste 50% või rohkem ning madalamate infarktide korral 70% või rohkem. . ST-segmendi dünaamika analüüs muutuva EKG abil, mis registreeritakse fikseeritud ajavahemike järel pärast trombolüüsi, on praegu kõige kättesaadavam ja lihtsam meetod reperfusiooni efektiivsuse kaudseks hindamiseks STEMI-ga patsientidel, mis on end tõestanud mitmetes uuringus. uurib selle kõrget spetsiifilisust ja prognostilist väärtust. Lahtiseks jääb aga küsimus, milline aeg on EKG dünaamika hindamiseks optimaalne – erinevate teadlaste hinnangul jääb see vahemikku 30–180 minutit ning mõned autorid soovitavad teha lõpliku otsuse mitte varem kui 24 tundi pärast TLT-d.
Mitmete ekspertide hinnangul võivad T-laine muutused kaudselt anda tunnistust pärgarteri verevoolu taastumise kasuks. Sel eesmärgil EKG analüüsi keerukamate lähenemisviiside kasutamine, näiteks müokardi isheemia raskusastme Anderson-Wilkinsi skoor, on jätkuvalt uurimisobjektiks.
Teiseks müokardi reperfusiooni markeriks peetakse niinimetatud "reperfusiooniarütmiate" tekkimist, mis tekivad 30-90 minuti jooksul pärast trombolüüsi ja mida võib kujutada mis tahes paikse kuuluvuse ekstrasüstoolia, kiirenenud idioventrikulaarse rütmi, ventrikulaarse tahhükardia, vatsakeste fib-sörkimise ja vatsakeste virvenduse. . Enamik eksperte usub, et "reperfusiooniarütmiate" tekkepõhjuseks on isheemilise müokardi verevoolu ebaühtlase taastumise tagajärjel taassisenemise või vallandava aktiivsuse tsoonide moodustumine. Siiski on ka teine seisukoht, mille kohaselt surmaga lõppevate ventrikulaarsete arütmiate ilmnemine varsti pärast TLT-d on märk taastumata verevoolust (reflow nähtus) või müokardi reperfusioonikahjustusest.
Uuringute ASSENT-2 ja ASSENT Plus kohaselt korreleeruvad EKG dünaamikanäitajad täpselt MI-ga patsientide suremusega pärast TLT-d. Seega jäävad praegu välja pakutud reperfusiooni õnnestumise EKG kriteeriumid arutelude objektiks.
Transtorakaalse ehhokardiograafia (EchoCG) meetod on erakorralise kardioloogia osakonna arsti diagnostilise arsenali lahutamatu osa töös MI-ga patsientidega. Siiski on meetodi potentsiaali maksimeerimise probleem endiselt aktuaalne.
Toimunud reperfusiooni laboratoorsed kriteeriumid hõlmavad müokardi nekroosi markerite - kardiotroponiinide, CPK, selle MV fraktsiooni - aktiivsuse järsku suurenemist järgmise 60-90 minuti jooksul pärast TLT-d. Sarnast nähtust seletatakse koronaarveenide väljavoolu taastamisega ja hävitavate ensüümide kõrvaldamisega üldisesse vereringesüsteemi. Kuid on ka vastupidist arvamust, mis seletab kardiospetsiifiliste ensüümide aktiivsuse suurenemist müokardi reperfusioonikahjustuse tekkega. Viimastel aastatel on ekspertide tähelepanu köitnud teised tõenäolised müokardi reperfusiooni markerid - D-dimeeri, C-reaktiivse valgu muutuste dünaamika, neutrofiilide / leukotsüütide suhe ja mitmed muud näitajad.
Rakendamine sisse kliiniline praktika süsteemid troponiinide T ja I kontsentratsiooni hindamiseks vereplasmas on muutnud müokardiinfarkti diagnoosimise ja patsientide jaotamise meetodid kõrge riskiga rühmadesse. Troponiinid T ja I on Venemaa Kardioloogide Seltsi, Ameerika Südameassotsiatsiooni (AHA) ja Euroopa Kardioloogide Seltsi (ESC) viimaste soovituste kohaselt müokardi nekroosi kardiospetsiifilised markerid.
Kirjanduse andmetel on troponiinid müokardi ja skeletilihaste universaalne valgu struktuur, mis paikneb kontraktiilse aparatuuri õhukestel müofilamentidel. Troponiinikompleks koosneb kolmest alaühikust – troponiin C, T ja I. Need valgud mängivad võtmerolli kaltsiumist sõltuvas lihaskontraktsiooni regulatsioonis. Müokardi troponiini C aminohappejärjestus on identne skeletilihases leiduvaga. Troponiin C-l puudub kardiospetsiifiline isovorm ja seetõttu ei saa seda kasutada müokardi kahjustuse diagnoosimiseks. Troponiinid T ja I eksisteerivad müokardispetsiifilistes isovormides, mis erinevad skeletilihaste isovormidest. Nende sünteesi kodeerivad spetsiifilised geenid ja neil valkudel on ainulaadne aminohappejärjestus. See seletab troponiinide T ja I müokardi isovormide tuvastamiseks kasutatavate meetodite absoluutset spetsiifilisust. Troponiini T molekulmass on 37 000 daltonit ja troponiin I molekulmass on 24 000 daltonit. Troponiin T sisaldus südame müotsüütides on ligikaudu 2 korda kõrgem kui troponiin I tase. Troponiine leidub rakkudes peamiselt struktuurilt sarnasel kujul. Enamik troponiinidest T ja I on osa kontraktiilsest aparaadist ja vabanevad selle ensümaatilise lagunemise tulemusena. Samuti on olemas sidumata troponiinide tsütosoolne kogum, mis vabanevad ägedalt, nagu teised tsütosoolsed ensüümid, näiteks CPK. Tsütoplasma sisaldab 6-8% troponiini T ja 2-4% troponiini I. Kardiotroponiinide vabanemine müokardi kahjustuse korral toimub järgmistes olukordades - pöörduva kahjustuse korral rikutakse müokardotsüütide membraani terviklikkust, ja see viib tsütosoolse kogumi troponiinide vabanemiseni ja kui kahjustus muutub pöördumatuks, põhjustab rakusisene atsidoos ja proteolüütiliste ensüümide aktiveerimine kontraktiilse aparatuuri hävimist, millele järgneb seotud troponiinide vabanemine. Tsütoplasmaatilised troponiini isovormid vabanevad kardiomüotsüütidest ligikaudu 4 tundi pärast potentsiaalselt pöördumatu kahjustuse tekkimist, saavutades tippväärtused 12 tunni pärast ja struktuurilt sarnased troponiinid - 24-48 tunni pärast. Troponiin I on veres tuvastatav 7-10 tunni pärast. päeva ja troponiin T - isegi 14 päeva pärast müokardiinfarkti algust. Troponiini kõrgenenud kontsentratsiooni tuvastamise kestus sõltub nekrootilise müokardi mahust, reperfusioonravist või revaskularisatsioonist ja neerude eritusvõimest.
On teada, et suurenenud troponiini taset saab tuvastada selliste haiguste korral nagu müokardiit, kopsuemboolia, neerupuudulikkus ja paljud muud patoloogiad. Alates 2000. aastast on ägeda müokardiinfarkti diagnoosimise ja prognoosimise "kuldstandardiks" troponiinide määramine vereseerumis. Troponiinide sisaldus vereplasmas on tihedalt seotud kahjustatud MI mahuga. Pärast reperfusioonravi võib troponiini sisalduse hindamine vereplasmas olla raske väljapesemisnähtuse rakendamise tõttu. Sellest tulenevalt ei ole soovitatav hinnata troponiinide T ja I taset mikrovaskulaarse müokardi kahjustuse fakti tuvastamiseks, mis võib tekkida ISCA ebapiisava avanemise tagajärjel pärast TLT-d.
Hetkel ei saa üheselt vastata, suurema tähtsusega on südame troponiinide (T või I) määramine. Esmapilgul on troponiin I spetsiifilisem südamemarker kui troponiin T, kuid olemasolevad troponiin I määramise meetodid on vähem standardiseeritud. Erinevad troponiin I testide tootjad kasutavad oma reagentides erinevaid antikehi ja erinevaid meetodeid kalibreerimine, nii et tulemusi on raske võrrelda. TNT määramise meetod on patenteeritud ja seda testi toodab ainult üks tootja.
Kreatiinfosfokinaas on lihaskoe ensüüm. MV-CPK on CPK (MV-CPK) südamevorm, mis on heterodimeer molekulmassiga 86 kDa. Skeletilihas sisaldab CPK lihaselist vormi (MM-CPK) ja vähem kui 3% MV-CPK-d. MV-CPK osakaal kogu CPK-st üle 5–6% on müokardi nekroosi spetsiifiline märk. Siiski on teada, et sellised haigused nagu krooniline neerupuudulikkus, insult, mõned onkoloogilised haigused, myasthenia gravis, traumaatilised operatsioonid võivad põhjustada CPK CF-fraktsiooni suurenemist ja sellest tulenevalt MI ülediagnoosimist. Enamik eksperte tunnistab, et kogu CPK määramine veres ei sobi MI diagnoosimiseks, kuna seda ensüümi leidub suurtes kogustes skeletilihastes ja see on müokardi nekroosi suhtes vähespetsiifiline. MI diagnoosimiseks peetakse eelistatavaks määrata MV-CPK mass. CPK CF-fraktsiooni tase seerumis hakkab tõusma 4–8 tunni pärast sümptomite ilmnemisest, saavutab haripunkti 24 tunni pärast ja normaliseerub 48–72 tunni pärast. See ajaline järjestus on oluline, kuna muudest allikatest pärit MV-CPK või muude südamepatoloogiate, näiteks müokardiidi korral, tavaliselt ei järgi seda seadust. Müokardiinfarkti korral põhjustab TLT ensüümi kiiret väljapesemist ja CPK MB fraktsiooni varasemat piiki.
D-dimeer on fibriini molekuli fragment, mis moodustub selle lagunemise käigus aktiivse plasmiini toimel. Seega võib selle omistada nii koagulatsiooni ja fibriini moodustumise aktivatsiooni markeritele kui ka fibrinolüüsi markeritele. D-dimeer moodustub hemokoagulatsiooni aktiveerumisel endoteeli limaskesta kahjustuse või sattumise tõttu veresoonümbritsevatest kudedest koefaktor - rakumembraanide komponent või aktiveerimisel sisemine tee koagulatsioon, mis on tingitud vere kokkupuutest võõra pinnaga või aktiivsete proteaaside sisenemine vereringesse. Trombi moodustumine algab siis, kui trombiini toimel muutub fibrinogeen fibriiniks ja see moodustab verehüübe ja trombi peamise raamistiku. Sellel protsessil on mitu etappi. Dimeerne fibrinogeeni molekul muundatakse monomeerseteks fibriini molekulideks, mis on võimelised polümeriseerima ja lõpuks moodustama lahustumatu fibriini polümeeri. Fibrinogeeni muutumisega fibriinmonomeerseteks molekulideks kaasneb fibrinopeptiidide A ja B lõhustumine. Vere hüübimisprotsessi lõpp-produktina olev fibriin toimib samaaegselt fibrinolüüsi peamise ensüümi plasmiini substraadina. Fibrinolüütiline süsteem on kohandatud fibriini lüüsiks. Fibrinolüüsi liigse aktiveerumisega on aga võimalik alustada fibrinogeeni lüüsi protsessi. Plasmiini toimel toimub fibrinogeeni ja fibriini järjestikuse lõhustamine. Selle protsessi käigus moodustuvad erineva molekulmassiga molekulid, mis erituvad fibriini ja fibrinogeeni lagunemise (FDP) produktidena. Fibriini (polümeeri molekuli) lagunemissaadused on suuremad fragmendid - D-dimeer ja trimeerid, mis sisaldavad kovalentset sidet fibriini molekuli fragmentide D-domeenide vahel. Fibrinogeeni lüüsimisel tekivad väiksemad üksikud oligopeptiidifragmendid. D-dimeer ei moodustu fibrinogeeni molekulist.
Mõnede haiguste puhul, mida iseloomustab vere hüübimisprotsesside aktiveerumine, toimub pidev fibrinogeeni üleminek fibriiniks ja selle tagajärjel suure hulga fibrinopeptiidide A ja B ilmumine vereringesse ning fibriini monomeeride akumuleerumine. . Samal ajal kaasneb fibrinolüüsi aktiveerimisega PDP-de suurenenud moodustumine, mis interakteeruvad monomeersete fibriini molekulidega, mis pole polümerisatsiooni läbinud. Nii moodustuvad lahustuvad fibriin-monomeersed kompleksid (RFMK), mis sisaldavad fibriini monomeere, fibrinopeptiide A ja B ning nende komplekse PDP-ga. Kõik need valgumolekulid moodustuvad fibriini trombi moodustumise ja seejärel selle lõhustamise tulemusena. D-dimeeri, PDP ja RFMK kontsentratsioon veres peegeldab kahte inimkehas pidevalt toimuvat protsessi, see on trombide teke ja trombolüüs. Järelikult saab neid näitajaid kasutada kliinilises ja laboratoorses praktikas nende protsesside hindamiseks.
D-dimeeri taseme dünaamika veres peegeldab olemasoleva trombi moodustumise ja hävimise protsessi. Vastavalt G.P. Arutjunov jt. D-dimeeri taseme tõusu dünaamikat saab kasutada teostatud trombolüüsi efektiivsuse markerina. Tema uuringus langes D-dimeeri plasmakontsentratsiooni varajane tõus pärast TLT-d kokku varasema müokardi reperfusiooni algusega ja oli seotud vasaku vatsakese funktsiooni säilimisega. On tõestatud, et D-dimeeri indeks vereplasmas peegeldab veresoonte aterosklerootiliste kahjustuste esinemist tervikuna ja selle indikaatori kvantitatiivne väärtus on võrreldav ateroskleroosi raskusastmega. Patsientide D-dimeeri väärtuste erinevus on seletatav fibrinolüüsisüsteemi erineva aktiivsuse astmega. D-dimeeri väärtuse normaliseerumine MI-ga patsientidel, mis tekkis spontaanselt või saavutati trombolüütilise ravi tõttu, vähendab korduvate trombootiliste sündmuste riski. Patsientidele, kellel on püsiv kõrge tase D-dimeer, võib olla soovitatav läbi viia agressiivsem trombotsüütidevastane ravi. Mõnede autorite sõnul jääb aga lahendamata küsimus D-dimeeri indeksi määramise vajadusest kardiovaskulaarse patoloogia tõttu hospitaliseeritud patsientidel. Nende arvates on sellel indikaatoril tundlikkuse ja spetsiifilisuse keskmised väärtused, see võib olla kasulik trombembooliliste sündmuste riski diagnoosimisel, kuid nõuab täiendavat uurimist ja kogemuste kogumist.
Seega on D-dimeeri indeksi kasutamise kliiniline tähtsus tohutu. Sellele laborikriteeriumile on pühendatud palju ülevaateid ja artikleid. Siiski on selle indikaatori uurimist kui laboratoorset kinnitust lõppenud või ebaõnnestunud reperfusiooni kohta pärast TLT-d vähe.
Sel korral teostatud kliiniliste tunnuste, EKG-näitajate, MI ja TLT laboratoorsete andmete õigeaegne dünaamiline hindamine aitab tuvastada patsiente, kellel on suur risk kardiovaskulaarsete tüsistuste tekkeks, ja kohandada kohe ravi. Sellega seoses otsitakse uusi markereid, sealhulgas laboratoorseid, ning juba teadaolevate markerite rolli, millel on kõrge ennustusväärtus seoses tüsistuste riski, haiguse kulgemise ja ravimi tulemuste jälgimisega. ravi ägeda koronaarsündroomi patsientidel on selgitamisel.
Järeldus
Kaasaegse kirjanduse ülevaate andmeid kokku võttes on oluline märkida, et STEMI trombolüüsi efektiivsuse kliiniline ja instrumentaalne hindamine on praktilise tähtsusega ning määrab suuresti edasiste tegevuste edukuse ja taktika. Kirjanduses käsitletud mitteinvasiivsed lähenemisviisid TLT efektiivsuse hindamiseks nõuavad selgitamist, struktureerimist ja igakülgset kaalumist.
Kirjandus
- Arablinsky A.V., Khairutdinov E.R., Tankhilevitš B.M. Erinevate reperfusioonravi tehnikate võimalused ST-segmendi tõusuga ägeda müokardiinfarktiga patsientidel // International Journal of Interventional Cardioangiology. 2011. nr 24. S. 78-81.
- Velkov V.V. Müokardiinfarkti ja ülitundlike troponiinide uued rahvusvahelised kriteeriumid: uued võimalused ja uued probleemid // Kliiniline laboratoorne diagnostika... 2014. T. 59. Nr 1. S. 43-53.
- Vertkin A. L., Morozova E. A., Morozova S. N. Trombolüüs haiglaeelses staadiumis: uuring "Ägeda koronaarsündroomiga patsientide register Kaug-Idas Föderaalringkond(ROKS-VOSTOK): ravi enne haiglaravi "[Elektrooniline ressurss] // Vene meditsiiniajakiri. 2014. nr 12.
- Vorobjeva N.M., Dobrovolski A.B., Titajeva E.V. Trombemboolsed tüsistused ja D-dimeeri diagnostiline tähtsus südame-veresoonkonna haigustes: 1000 patsiendi retrospektiivne uuring // Kardioloogiline bülletään. 2011. 2. kd 10-15.
- Gerasimenko V.A., Oganesjan N.A. D-dimeeri kontsentratsiooni hindamine kliinilises ja laboratoorses praktikas // CDL juhataja käsiraamat. 2011. nr 5. S. 47-53.
- Gratšev V.G., Liptšenko A.A., Kozlov S.V. Kombineeritud farmakoinvasiivne strateegia ST-segmendi tõusuga müokardiinfarkti raviks // Kiirabi tervishoid... 2013. T. 14, nr 4. S. 10-13.
- Elanike tervisliku seisundi ja tervishoiukorralduse aruanne Vene Föderatsiooni moodustavate üksuste täitevvõimude tegevuse tulemuste põhjal 2017. aasta kohta // Vene Föderatsiooni tervis. 2018.nr 1.P 5-36.
- Zalevskaja N.G. Kaasaegsed meetodid müokardiinfarkti laboratoorseks kinnitamiseks. Belgorodi Riikliku Ülikooli teadusbülletään. Seeria: Meditsiin. apteek. 2011. T. 14, nr 10. S. 263-267.
- D. A. Zateištšikov Trombolüütiline ravi tenekteplaasiga ägeda koronaarsündroomi korral vaskulaarse programmi kontekstis // Raske patsient. 2014. nr 10. S. 5-11.
- Zeltõn-Abramov E.M., Radzevitš A.E., Bedjajev L.V. Trombolüütilise ravi ajal ST-segmendi tõusuga müokardiinfarkti tulemuste võrdlev analüüs // Kiirabi arst. 2010. nr 12. S. 36-41.
- E. S. Kropatševa, E. P. Pantšenko Antitrombootiline ravi koronaarse verevoolu taastamiseks EKG-s ST-segmendi elevatsiooniga ägeda koronaarsündroomiga patsientidel // Russian Medical Journal. 2013. nr 4. S. 214-219.
- Mazur N.A. Praktiline kardioloogia (neljas muudetud väljaanne). M .: Medpraktika-M, 2015.680 lk.
- Markov V.A., Rjabov V.V., Maksimov I.V. Eile, täna, homme müokardiinfarkti diagnoosimises ja ravis // Siberi meditsiiniajakiri. 2011. T. 26, nr 2 (1). S. 8-13.
- Neimark N.Z., Zajašnikov S.V., Kalugina O.A. Reperfusioonisündroomi ennustajad ST-tõusuga ägeda müokardiinfarkti taustal // Kazani meditsiiniajakiri. 2011. T. 92. nr 3. S. 357-359.
- Ostroumova L.A., Shalaeva S.V., Yarkov I.V. Kaasaegsete strateegiate roll ägedate koronaarsündroomide põhjustatud surmariski vähendamisel // Ural Medical Journal. 2013. nr 1. S. 78-83.
- Ruda M. Ya., Averkov O. V., Golitsyn S. P.Ägeda müokardiinfarktiga patsientide diagnostika ja ravi elektrokardiogrammi ST segmendi elevatsiooniga. Kliinilised juhised// Kardioloogiline bülletään. 2014. nr 4. S. 2-59.
- Kardioloogia juhend neljas köites. 2. köide: Diagnostikatehnikad südame-veresoonkonna haigus/ Toim. akad. E. I. Chazova, Moskva: Praktika, 2014.776 lk.
- Saprygin D. B., Romanov M. Yu. Troponiinide I ja T, kreatiinkinaasi MB ja müoglobiini väärtus ägeda müokardiinfarkti diagnoosimisel // Laboratory Medicine. 2000. nr 3. C. 13-17.
- Syrkin A.L. Müokardiinfarkt (kolmas muudetud väljaanne). M .: MIA, 2006.466 lk.
- Antman E. M., Cohen E. M. M., Bernink P. J. L. M. TIMI riskiskoor ebastabiilse stenokardia / ST elevatsioonita MI korral: prognoosimise ja terapeutiliste otsuste tegemise meetod // JAMA. 2000. Vol. 284, nr 7. Lk 835-842.
- Araszkiewicz A., Grygier M., Lesiak M. Isheemia-reperfusioonikahjustuse mõju primaarse angioplastika efektiivsusele ST-segmendi elevatsiooniga müokardiinfarkti korral. Postepy // Kardiol Interwencyjnej. 2013. Kd. 9, nr 3. Lk 275-281.
- Armstrong P. W., Gershlick A. N., Goldstein P. Strateegilise reperfusiooni varakult pärast müokardiinfarkti (STREAM) uuring // Am Heart J. 2015. Vol. 160, nr 1. Lk 1-35.
- Clemmensen P., Ohman M., Sevilla D. C. Standardse elektrokardiograafilise ST-segmendi elevatsiooni muutused, mis ennustavad edukat reperfusiooni ägeda müokardiinfarkti korral // Am. J. Cardiol. 2009. Vol. 66. Lk 1407-1411.
- Gremmel T., Ay C., Seidinger D. Lahustuv p-selektiin, D-dimeer ja kõrge tundlikkusega C-reaktiivne valk pärast alajäseme ägedat süvaveenide tromboosi // J. Vasc. Surg. 2011. Vol. 54. Lk 48-55.
- Heeschen C., Hamm C., Goldman B. Troponiini kontsentratsioonid ägeda koronaarsündroomiga patsientide kihistamiseks seoses triofikliide terapeutilise efektiivsusega // Lancet. 1999. Vol. 354. Lk 1757-1762.
- Heidenreich P., Alloggiamento T., Hagan V. Troponiini prognostiline väärtus ST-tõusuta ägedate koronaarsündroomidega patsientidel: metaanalüüs // J Am Coll Cardiol. 2000. Vol. 35, nr 2. Lk 267-280.
- Hugli O., Aujesky D. Valepositiivse D-dimeeri lahendamata probleem toob kaasa kopsuemboolia diagnostilise töö // Rev. Med. Suisse. 2011. Vol. 305, nr 7. Lk 1588-1592.
- Morrison L. J., Verbeek P. R., McDonald A. C. Suremus ja haiglaeelne trombolüüs ägeda müokardiinfarkti korral. Metaanalüüs // JAMA. 2000. Vol. 283. Lk 2686-2692 ..
- Occludated koronaararterite avamise strateegiate globaalne kasutamine (GUSTO) IIb uurijate jaoks. Rekombinantse hirudiini ja hepariini võrdlus ägedate koronaarsündroomide raviks // The New England Journal of Medicine. 2011. Vol. 335. Lk 775-782.
- Thygesen K., Alpert J. S., Jaffe A. S. Müokardiinfarkti kolmas universaalne määratlus // J Am Coll Cardiol. 2012. Vol. 60. Lk 1581-1598.
- Van de Werf F., Cannon C. P., Luyten A. TNK koe-plasminogeeni aktivaatori ühe boolusannuse ohutuse hindamine ägeda müokardiinfarkti korral: ASSENT-1 uuring // Am. Heart J. 2014. Vol. 137. Lk 786-791.
E. M. Podgornaja 1
L.I. Markova,
O. L. Belaya, Meditsiiniteaduste doktor, professor
K. I. Teblojev,Meditsiiniteaduste doktor, professor
GBOU VO MGMSU neid. A.I. Evdokimova, Vene Föderatsiooni tervishoiuministeerium, Moskva
Kaasaegsed meetodid trombolüüsi efektiivsuse hindamiseks ST-segmendi elevatsiooniga müokardiinfarktiga patsientidel / E. M. Podgornaja, L. I. Markova, O. L. Belaya, K. I. Tebloev
Viitamiseks: raviarst nr 11/2018; Leheküljenumbrid väljaandes: 74-78
Sildid: süda, trombolüüs, müokardi reperfusioon
See on kliiniliste ja labori-instrumentaalsete märkide rühm, mis viitavad selle esinemisele ebastabiilne stenokardia või müokardiinfarkt. Seisund väljendub üle 20 minuti kestvas valus rinnus, millega kaasneb higistamine, õhupuudus ja naha kahvatus. 15-20% patsientidest on ebatüüpilised kliiniline kulg sündroom. Diagnostika jaoks viiakse läbi kardiospetsiifiliste ensüümide analüüs, registreeritakse EKG. Narkootikumide ravi hõlmab trombolüütikumide, trombotsüütide agregatsiooni vastaste ainete ja antikoagulantide, stenokardiavastaste ravimite kasutamist. Rasketel juhtudel on näidustatud kirurgiline revaskularisatsioon.
RHK-10
I20.0 I21 I24.8 I24.9

Üldine informatsioon
Äge koronaarsündroom (ACS) on esialgne diagnoos, mis määratakse patsiendi esmakordsel läbivaatusel üldarsti poolt. Termin tekkis seoses vajadusega valida kiireloomuliste seisundite ravitaktika, ootamata lõplikku diagnoosi. ACS ja selle tüsistused on täiskasvanud elanikkonna kõigi suremuse põhjuste hulgas esikohal (umbes 48%). Alla 60-aastastel meestel määratakse arstiabi 3-4 korda sagedamini kui naistel. 60-aastaste ja vanemate patsientide rühmas on meeste ja naiste suhe 1: 1.

Põhjused
Kõigil nosoloogilistel üksustel, mis moodustavad ägeda koronaarsündroomi, on ühised etioloogilised tegurid. Haiguse peamiseks põhjuseks on koronaarsoonte tromboos, mis tekib aterosklerootilise naastu erosiooni või rebenemise ajal (aterotromboos). Koronaararteri oklusioon trombiga esineb 98% patsientidest kliiniline pilt OK. Tromboosi korral on koronaarsündroomi tekkimine seotud nii arteri mehaanilise ummistumise kui ka spetsiifiliste vasokonstriktorite vabanemisega.
Ägeda protsessi teine etioloogia on äärmiselt haruldane (umbes 2% juhtudest). ACS-i ilmnemine on võimalik koronaararteri trombemboolia või rasvemboolia korral. Veelgi harvemini diagnoositakse koronaararterite mööduv spasm - Prinzmetali variantstenokardia.
Riskitegurid
Kuna enamik episoode on seotud aterosklerootiliste tüsistustega, on koronaarsündroomi riskifaktorid identsed ateroskleroosi riskiteguritega. Eristama:
- Mittemodifitseeritavad tegurid: meessugu, vanadus, pärilik eelsoodumus;
- Korrigeerivad tegurid: ülekaal, halvad harjumused, füüsiline passiivsus.
Suurim oht eeldustest on arteriaalne hüpertensioon. Kõrge vererõhk aitab kaasa ateroskleroosi varasemale algusele ja kiiremale progresseerumisele.
Patogenees
Patofüsioloogiline põhihaigus on verevoolu äge vähenemine ühes koronaarsoontes. Tulemuseks on tasakaal lihaskiudude hapnikuvajaduse ja varustatuse vahel arteriaalne veri... Ägeda koronaarsündroomi korral tekib mööduv või püsiv isheemia, mis progresseerumisel põhjustab orgaanilisi muutusi müokardis (nekroos, düstroofia).
Kui aterosklerootilise naastu kiuline kate puruneb, ladestuvad vereliistakud ja fibriini kiud – moodustub tromb, mis blokeerib veresoone valendiku. Sündroomi patogeneesis mängivad olulist rolli hemostaatilised häired, mis põhjustavad mikrotrombide moodustumist müokardi toitvates veresoontes. Raskeid kliinilisi sümptomeid täheldatakse koronaararteri valendiku ahenemisega vähemalt 50-70%.
Klassifikatsioon
Tüsistused
Selle seisundi ägedal perioodil on suur risk südame äkksurma tekkeks: ligikaudu 7% ACS-i korral ST-segmendi elevatsiooniga, 3-3,5% koronaarsündroomi korral normaalse ST-ga. Varased tüsistused avastatakse keskmiselt 22% patsientidest. Haiguse kõige sagedasem tagajärg on kardiogeenne šokk, mida diagnoositakse meestel kaks korda sagedamini. Üle 50-aastastel patsientidel tekivad reeglina tõsised rütmi- ja juhtivushäired.
Ägeda südameinfarkti eduka leevendamise korral jääb 6–10% patsientidest risk hiliste tüsistuste tekkeks, mis tekivad 2–3 nädalat pärast sündroomi tekkimist. Seoses lihaskiudude lõigu asendamisega sidekoe on võimalus kroonilise südamepuudulikkuse, südame aneurüsmi tekkeks. Kui keha sensibiliseeritakse autolüüsitoodetega, tekib Dressleri sündroom.
Diagnostika
Võttes arvesse ägeda stenokardiahoo tüüpilisi ilminguid, saab kardioloog teha esialgse diagnoosi. Füüsiline läbivaatus on vajalik, et välistada valu mittekardiaalsed põhjused ja mitteisheemilise päritoluga südamehäired. Koronaarsündroomi erinevate variantide eristamiseks ja ravitaktika valikuks viiakse läbi kolm põhiuuringut:
- Elektrokardiograafia. Diagnostika "kuldstandard" on EKG registreerimine 10 minuti jooksul alates ägeda rünnaku algusest. Koronaarsündroomi iseloomustab ST tõus üle 0,2-0,25 mV või selle depressioon rindkere juhtmetes. Müokardi isheemia esimene märk on terav kõrge T-laine.
- Biokeemilised markerid... Südameinfarkti välistamiseks analüüsitakse kardiospetsiifiliste ensüümide sisaldust - troponiinid I ja T, kreatiinfosfokinaas-MB. Varaseim marker on müoglobiin, mis tõuseb haiguse esimestel tundidel.
- Koronaarangiograafia. Koronaarveresoonte uurimise invasiivset meetodit kasutatakse pärast ST-segmendi tõusu tuvastamist kardiogrammil. Koronaarangiograafiat kasutatakse trombist kahjustatud arteri revaskularisatsiooni ettevalmistamise etapis.
Pärast seisundi stabiliseerumist ja ägeda koronaarsündroomi kõrvaldamist määrab spetsialist täiendavaid diagnostilisi meetodeid. Kindlaksmääratud koronaartõve diagnoosiga patsientide riski hindamiseks on soovitatav teha mitteinvasiivseid koormusteste, mis näitavad südame funktsionaalsust. Ehhokardiograafia tehakse vasaku vatsakese väljutusfraktsiooni mõõtmiseks ja suurte veresoonte visualiseerimiseks.
Ägeda koronaarsündroomi ravi
Konservatiivne ravi
ACS-iga patsientide ravi toimub ainult spetsialiseeritud kardioloogiahaiglates, patsiendid raske seisund hospitaliseeritud intensiivravi osakondadesse. Terapeutiline taktika sõltub koronaarsündroomi variandist. Kui kardiogrammil on ST elevatsioon, diagnoositakse äge müokardiinfarkt. Sel juhul on näidustatud intensiivne ja trombolüütiline ravi vastavalt standardskeemile.
Patsientidele, kellel ei ole püsivat ST elevatsiooni, määratakse kombineeritud ravimteraapia ilma trombolüütikumideta. Rünnaku peatamiseks kasutatakse nitraate. Edasine ravi on suunatud müokardi isheemiliste protsesside kõrvaldamisele, vere reoloogiliste omaduste normaliseerimisele ja vererõhu korrigeerimisele. Sel eesmärgil on soovitatav kasutada mitut ravimirühma:
- Trombotsüütide vastased ained... Trombide tekke vältimiseks võetakse atsetüülsalitsüülhappe või tienopüridiini derivaatide baasil põhinevaid ravimeid. Pärast esialgseid küllastusannuseid lähevad nad üle pikaajalisele ravimile keskmistes terapeutilistes annustes. Esimesel 2-5 päeval täiendatakse skeemi antikoagulantidega.
- Isheemilised ravimid... Südame verevarustuse parandamiseks ja südamelihase hapnikuvajaduse vähendamiseks kasutatakse mitmeid ravimeid: kaltsiumikanali blokaatorid, nitraadid, beetablokaatorid. Mõnel neist ravimitest on antihüpertensiivne toime.
- Lipiidide taset alandavad ravimid... Kõikidele patsientidele määratakse statiinid, mis alandavad üldkolesterooli ja aterogeense LDL-kolesterooli taset veres. Teraapia vähendab ägeda koronaarsündroomi korduva arengu riski, parandab oluliselt prognoosi ja pikendab patsientide eluiga.
Kirurgia
Müokardi revaskularisatsioon on efektiivne infarkti ja korduva isheemia korral, mis ei allu ravimravile. Valikmeetodiks on minimaalselt invasiivne endovaskulaarne angioplastika, mis taastab kiiresti verevoolu kahjustatud anumas ja millel on lühike taastumisperiood. Kui see on võimatu, on näidustatud koronaararterite šunteerimine.
Prognoos ja ennetamine
Õigeaegne intensiivravi alustamine vähendab oluliselt varajaste ja hiliste tüsistuste riski ning vähendab suremust. Prognoos on kindlaks määratud kliiniline võimalusäge koronaarsündroom, kaasuvate südamehaiguste esinemine. 70-80% patsientidest on enne väljakirjutamist madal või keskmine aste risk, mis vastab vasaku vatsakese säilinud funktsioonile.
Haiguse mittespetsiifiline ennetamine hõlmab riskitegurite muutmist - kehakaalu normaliseerimist, halbade harjumuste ja rasvase toidu tagasilükkamist. ACS-i korduvate episoodide ennetamine hõlmab pikaajalist (üle 12 kuu) trombotsüütidevastast ravi ja lipiidide taset alandavate ravimite kasutamist. Ägeda koronaarsündroomi läbinud patsiendid registreeritakse kardioloogi juures.
4286 0
- Anesteesia... Stenokardiahoo leevendamine on müokardiinfarkti ravi lahutamatu osa. Valu leevendamine peaks olema kiire ja võimalikult täielik.
- Valikravimiteks on narkootilised analgeetikumid, millel on lisaks tugevale valuvaigistavale toimele ka väljendunud rahustav toime.
Kõige sagedamini kasutatakse morfiini, mis lahjendatakse vähemalt 10 ml 0,9% naatriumkloriidi lahuses ja süstitakse aeglaselt intravenoosselt annuses 2-4 mg. Vajadusel korratakse vastuvõttu iga 10-15 minuti järel annuses 2-6 mg kuni efekti saavutamiseni või kõrvaltoimete ilmnemiseni.
Vähem intensiivse rünnaku korral määratakse intravenoosne trimeperidiin (promedool) annuses 20 mg.
Opioidide kõrvaltoimed: arteriaalne hüpotensioon, raske bradükardia (kontrollitud atropiini 0,5-1,5 mg intravenoosse infusiooniga), iiveldus, oksendamine (kontrollitakse fenotiasiini derivaatide, metoklopramiidiga), hingamisdepressioon. Hingamispuudulikkuse korral määratakse intravenoosne naloksoon annuses 0,1-0,2 mg, vajadusel süstitakse uuesti 15 minuti pärast.
- Mõnikord kasutatakse neuroleptanalgeesiat – narkootiliste analgeetikumide ja antipsühhootikumide kombinatsiooni (0,05 mg fentanüüli ja 2,5 mg droperidooli).
- Harvemini kasutatakse ataralgeesiat – narkootiliste analgeetikumide ja rahustite kombinatsiooni.
- Kui stenokardiahoog ei leevendu ülaltooduga ravimid, harvadel juhtudel kasutage inhalatsioonianesteesia vahendeid [dinlämmastikoksiid (lämmastikoksiid)].
- Teised valu leevendamise meetodid (tspiduraalanalgeesia, elektrianesteesia) ei ole ST-segmendi elevatsiooniga ägeda koronaarsündroomi ravis veel laialt levinud.
- Trombolüütiline ravi- ST-segmendi elevatsiooniga müokardiinfarkti ravi peamine patogeneetiline meetod.
- Trombolüütiline ravi on näidustatud patsientidele, kellel on valu või ebamugavustunne rinnus kauem kui 30 minutit, kes ei lõpe pärast nitraatide võtmist või puhkeolekus, kui haigus on alla 12 tunni vana ja EKG-l on üks järgmistest tunnustest:
Äge (või oletatavasti äge) ST-segmendi tõus punktis J kahes või enamas kõrvuti asetsevas juhtmes, üle 0,2 mV (2 mm) juhtmetes V1, V2 või V3 ja üle 0,1 mV (1 mm) ülejäänud juhtmetes.
Äge vasakpoolse kimbu blokaad (või oletatavasti äge), mis raskendab ST-segmendi analüüsi.
ST-segmendi depressioon eesmises südamelihases koos kõrge R-lainega, mis viitab tõelise tagumise MI olemasolule. Sellistel juhtudel tuleb EKG teha täiendavates südameapelmejuhtmetes V7-V9.
- Oluline on teada ja kiiresti hinnata trombolüütilise ravi vastunäidustuste olemasolu:
Absoluutne:
Anamneesis hemorraagiline insult või teadmata etioloogiaga insult;
isheemiline insult viimase 6 kuu jooksul;
Teadvuse puudumine;
Aordi seina dissektsioon;
Kesknärvisüsteemi kahjustused või neoplasmid;
Hiljutine (eelmise 3 nädala jooksul) suur trauma, operatsioon või peavigastus;
Seedetrakti verejooks eelmisel kuul;
Hemorraagiline diatees.
Sugulane:
Mööduv tserebrovaskulaarne õnnetus eelmisel kuul;
NACG ravi;
rasedus ja esimene nädal pärast sünnitust;
Mittekokkusurutavate veresoonte, näiteks subklavia veeni funktsioon;
Traumaatilised elustamismeetmed;
Refraktaarne raske hüpertensioon;
Raske maksafunktsiooni häire;
Nakkuslik endokardiit;
Haigus on ägedas faasis.
- Trombolüütilise ravi maksimaalne positiivne mõju ilmneb esimese 3 tunni jooksul alates haiguse algusest ja eriti esimese "kuldse" tunni jooksul. Aeg haiglaravi hetkest trombolüütilise ravi alguseni ei tohi ületada 30 minutit.
- Trombolüüsi standardsete näidustuste olemasolul on näidustatud mis tahes trombolüütilise ravimi määramine. Trombolüüsi ravimi valik sõltub selle saadavusest ja maksumusest. Eelistatav on alati kasutada fibriinispetsiifilisi ravimeid. Trombolüütikumide manustamisskeem ja peamised omadused on toodud tabelis. 1.
- Trombolüütilise ravi peamised kõrvaltoimed on:
Verejooks.
Hemorraagiline insult.
Palavik.
Arteriaalne hüpotensioon.
Anafülaksia.
Reperfusiooni rütmihäired.
- Trombolüütikumide põhjustatud verejooksu korral manustatakse tavaliselt värskelt külmutatud plasmat, protamiinsulfaati, trombotsüütide massi, krüopretsipitate.
- Angiograafia abil on võimalik objektiivselt hinnata trombolüütilise ravi efektiivsust, kaudselt - muude meetodite põhjal.
CAG-i abil on võimalik kahjustatud koronaararterit vahetult visualiseerida ja hinnata verevoolu taastumise astet selles.
Kõige tavalisem ja kättesaadavam kaudne meetod on ST-segmendi dünaamika hindamine EKG-l. Kui koronaarne verevool taastub, jälgige kiire langus ST segment juhtmetes, milles see oli kõrgendatud. EKG registreeritakse 90 ja 180 minutit pärast trombolüütilise ravi algust. ST-segmendi langust enam kui 50% võrreldes esialgne tasemega, kus selle tõus oli maksimaalne, peetakse reperfusiooni märgiks. Kui ST-segment väheneb enne trombolüütilise ravi alustamist näidatud koguse võrra, kahtlustatakse spontaanset reperfusiooni.
teised kaudne märk reperfusioon, on müokardi nekroosi markerite kiire dünaamika.
Tabel 1
Trombolüütiliste ravimite võrdlusomadused
| Tehnilised andmed | Streptokinaas | Alteplaza | Reteplaza | Prourokinaas |
| Päritolu Poolväärtusaeg, min Ainevahetus Rakendusviis Täiendav antikoagulantravi Antigeensus Fibriini spetsiifilisus Hemorraagilise insuldi tekkimise oht Süsteemse verejooksu tekkimise oht Häiritud verevoolu taastamise efektiivsus 90 min pärast Vähenenud suremus | C-rühma streptokokk Maksa kaudu Intravenoosne infusioon Atsetüülsalitsüülhape sees annuses 325 mg / päevas | Rekombinantne DNA Maksa kaudu Intravenoosne annus 100 mg: | Rekombinantne DNA Neerude kaudu Intravenoosne boolus 2 miljonit RÜ, seejärel annuses 6 miljonit RÜ infusioonina 60 minutit Atsetüülsalitsüülhape suukaudselt annuses 325 mg / päevas, intravenoosne hepariin Tundmatu | Rekombinantne DNA Maksa kaudu Ühekordne intravenoosne boolussüst annuses 30-50 mg (0,5 mg / kg kehamassi kohta) Atsetüülsalitsüülhape suukaudselt annuses 325 mg / päevas, intravenoosne hepariin
++
|
- Antikoagulandid.
UFH on ette nähtud fibriinispetsiifiliste trombolüütikumide (alteplaas, reteplaas, tenekteplaas) kasutamisel. Streptokinaasi kasutamisel ei ole antikoagulante näidustatud. Lisaks määratakse UFH, kui trombolüütilist ravi ei manustata. Nendel juhtudel on selle antikoagulandi ravi kestus 1-2 päeva. UFH-d kasutatakse ka PTCA-s kaasneva ravina.
UFH määramiseks on täiendavad näidustused: intrakardiaalne tromboos, raske südamepuudulikkus, venoosne tromboos, PE. Sellistel juhtudel võib antikoagulantravi kestust pikendada.
UFH-d kasutatakse annuses 70 U / kg kehamassi kohta intravenoosselt boolusena (kuid mitte rohkem kui 5000 U), seejärel intravenoosse infusioonina kiirusega 12-18 U / kg kehamassi kohta tunnis, hoides APTT tasemel. 50-70 s (1,5-2 korda normist). Kui manustatakse koos glükoproteiini IIb / IIIa retseptorite blokaatoritega, süstitakse UFH boolusena annuses 60 U / kg kehamassi kohta, kuid mitte rohkem kui 4000 U, ja järgnevat infusiooni ei teostata.
- NMH. LMWH-d saab kasutada MI korral UFH alternatiivina. Selle rühma kahe ravimi efektiivsus ja ohutus ST-segmendi elevatsiooniga ägeda koronaarsündroomiga patsientide ravis on tõestatud.
Naatriumenoksapariini manustatakse subkutaanselt annuses 1 mg / kg kehamassi kohta iga 12 tunni järel Ravi kestus on 3-5 päeva. Kõigil enoksapariini saavatel patsientidel tuleb kontrollida neerufunktsiooni ja kui tuvastatakse neerupuudulikkuse nähud, tuleb ravimi annust vähendada.
Revipariinnaatriumi määratakse subkutaanselt 2 korda päevas 7 päeva jooksul annuses 3436 RÜ patsientidele kehakaaluga alla 50 kg, 5153 RÜ patsientidele kehakaaluga 50–75 kg ja 6871 RÜ patsientidele kehakaaluga üle 75 kg.
- Võrreldava kliinilise efektiivsuse põhjal on eelistatav kasutada LMWH-d, kuna manustamisviis on lihtsustatud ja puudub vajadus laborikontrolli järele. Suurema verejooksuriski tõttu ei soovitata LMWH-d siiski üle 75-aastastele patsientidele. Raske neerupuudulikkuse korral (kreatiniini kontsentratsioon veres on meestel üle 221 μmol / l ja naistel üle 177 μmol / l) on parem LMWH väljakirjutamisest hoiduda.
- Kui antikoagulantravi on kestnud üle 48 tunni, tuleb trombotsüütide arvu iga päev jälgida trombotsütopeenia ohu tõttu.
- Patsientidel, kellel on raske veenilaiendid alajäsemete veenid, anamneesis tromboflebiit, raske südamepuudulikkus, pikaajaline voodirežiim, venoosse tromboosi ja emboolia ennetamine:
UFH 7500-12500 RÜ subkutaanselt 2 korda päevas.
Naatriumenoksapariin 40 mg subkutaanselt 1 kord päevas või daltepariinnaatrium 5000 RÜ subkutaanselt 1 kord päevas.
- NACG.
NACT on ette nähtud juhul, kui on vaja pikaajalist antikoagulantravi.
LV tromboos;
Pidev kodade virvendus;
CHF, mille väljutusfraktsioon on alla 30%;
Trombemboolia ajalugu.
Tavaliselt antakse varfariini INR-iga 2–3 (sihttase 2,5). Kui patsiendid saavad atsetüülsalitsüülhapet ja/või klopidogreeli nende puudumisel täiendavad näidustused, NACG-d tavaliselt ei määrata. On tõendeid, et varfariini manustamine alla 75-aastastele ST-tõusuga ägeda koronaarsündroomi patsientidele lisaks atsetüülsalitsüülhappele või monoteraapiana vähendab suremust ja insultide esinemissagedust. Veritsusohu, pideva laboratoorse jälgimise vajaduse tõttu määratakse varfariini aga harva ilma erinäidustusteta. Trombotsüütide vastaste ainete vastunäidustuste või talumatuse korral on NACG näidustatud vastavalt tavapärasele skeemile.
- Disaggregandid.
- Atsetüülsalitsüülhape (aspiriin) on vastunäidustuste puudumisel näidustatud kõigile ST-segmendi elevatsiooniga ägeda koronaarsündroomi patsientidele. Ravimi väljakirjutamisega kaasneb oluline prognoosi paranemine, suremuse vähenemine ja kordusinfarkti oht. Algannus on 250-500 mg, kui ravimit ei määratud varem. Toime alguse kiirendamiseks, samuti tugeva iivelduse, söögitoru, maohaiguste korral on võimalik ravimit manustada intravenoosselt annuses 300-500 mg või suposiitide kujul. Säilitusannus on 75-150 mg päevas. Tavaliselt kasutatakse enterokattega ravimit või "pehmet" vormi. Pärast haavandilist verejooksu võib atsetüülsalitsüülhapet välja kirjutada mitte varem kui 8 nädalat hiljem. Kui anamneesis on peptiline haavand, on lisaks näidustatud prootonpumba inhibiitorid (omeprasool). Puudub üldtunnustatud seisukoht selle kohta, kas atsetüülsalitsüülhappega ravi efektiivsust on soovitatav jälgida agregatomeetria abil.
- Klopidogreel on tienopüridiin, mis pärsib pöördumatult ADP poolt indutseeritud trombotsüütide agregatsiooni. Ravim on näidustatud kõigile ST-segmendi elevatsiooniga ägeda koronaarsündroomi patsientidele. Tavaliselt on küllastusannus 300 mg suukaudselt, kuid kui PTCA on planeeritud järgmise 2 tunni jooksul, suurendatakse annust 600 mg-ni. Säilitusannus on 75 mg päevas. Klopidogreeli määramise vastunäidustused hõlmavad kinnitatud ülitundlikkust, aktiivset verejooksu, ägenemist peptiline haavand ja ajuverejooks. Praegu on klopidogreeli kasutamise efektiivsus ST-segmendi elevatsiooniga ägeda koronaarsündroomi haiglaravi ajal tõestatud. Kui on tehtud PTCA koos stentimisega, eriti ravimit elueerivate stentide implanteerimisel, tuleb klopidogreeli võtta aasta.
- Glükoproteiini IIb / IIIa retseptorite blokaatorid (abtsiksimab, tirofibaan jt) olid ebaefektiivsed, kui neid kasutati koos trombolüütikumidega. Kasutamisnäidustused piirduvad kavandatud TBCA-ga juhul, kui klopidogreeli ei määratud või tal ei olnud aega tegutseda.
- Nitroglütseriin.
- Tüsistusteta müokardiinfarktiga patsientidel ei kaasne nitroglütseriinraviga prognoosi paranemist. Siiski on tavaks teha 12-24-tunnist infusioonravi nitroglütseriiniga kõigil MI-ga patsientidel. Olemas kliinilised näidustused, mille puhul on vajalik nitraatide määramine: püsiv stenokardiahoog, südamepuudulikkuse nähud, kontrollimatu hüpertensioon.
- Üle 24 tunni kestvate infusioonide korral on nitraaditaluvuse tekkimise tõenäosus suur. Selle vältimiseks määratakse neid perioodiliselt, et väljutada päeva jooksul nitraatide mittetoimimise perioodi. Sellise perioodi kestus peaks olema vähemalt 10-12 tundi.
- Põhiline kõrvalmõju- arteriaalne hüpotensioon, mis tavaliselt kaob kiiresti pärast infusiooni lõppu. Üsna sageli täheldatakse tugevat peavalu, mis mõnikord takistab ravi jätkamist.
- Nitroglütseriini esialgne infusioonikiirus peaks olema 10 μg / min. Seejärel suurendatakse kiirust 10 μg/min iga 3-5 minuti järel, kuni vererõhk langeb või sümptomid paranevad. Vererõhku ei tohiks langetada alla 100 mm Hg. normaalse vererõhuga isikutel või üle 25% algtasemest hüpertensiooniga patsientidel. Maksimaalne annus(süstimise kiirus) nitroglütseriini on 200 μg / min.
- Ärge kasutage RV MI jaoks nitraate.
- β-blokaatorid.
- β-blokaatorid on ühed peamised ravimid, mida kasutatakse ST-segmendi elevatsiooniga ägeda koronaarsündroomi ravis. On tõestatud, et need hoiavad ära ohtlikke rütmihäireid, vähendavad müokardiinfarkti kordumise riski ja omavad isheemivastast toimet. Andmed mõju kohta ST-segmendi elevatsiooniga ägeda koronaarsündroomiga patsientide suremusele on vastuolulised.
Vastunäidustuste puudumisel on kõikidele MI-ga patsientidele alates haiguse esimestest tundidest näidustatud ilma sisemise sümpatomimeetilise aktiivsuseta β-blokaatorite määramine. Ulatusliku müokardiinfarkti või südamepuudulikkuse nähtudega patsientidel algab ravi selle rühma ravimitega intravenoosne manustamine... Tavaliselt kasutatakse selleks propranolooli, esmolooli, metoprolooli või atenolooli. Kui β-blokaatoreid ei saa müokardiinfarkti esimesel päeval välja kirjutada, tuleks pidevalt hinnata nende kasutamise võimalust tulevikus.
- Propranolooli manustatakse intravenoosselt 1 mg iga 5-10 minuti järel koguannuses kuni 6-10 mg (0,1 mg / kg kehamassi kohta). Hea taluvuse korral määratakse ravim 1 tunni pärast suu kaudu 10-20 mg iga 4 tunni järel. päevane annus jõuab 480 mg-ni.
- Metoprolooli manustatakse intravenoosselt annuses 5 mg koos võimalusega uuesti manustada 5–10 minuti pärast koguannuseni 15–20 mg. 1 tunni pärast võib ravimit manustada suu kaudu 25-50 mg iga 6-8 tunni järel Maksimaalne ööpäevane annus on kuni 300 mg.
- Atenolooli määratakse intravenoosselt annuses 5 mg, võimalusega uuesti manustada 5–10 minuti pärast koguannuseni 15–20 mg. 1 tunni pärast pärast ravimi võtmist lähevad nad üle ravimi sissevõtmisele 12,5-25 mg iga 8-12 tunni järel Maksimaalne ööpäevane annus ei tohi ületada 200 mg.
- Esmolooli kasutatakse intravenoosse infusioonina annuses 0,1 mg / kg kehamassi kohta minutis, suurendades 0,05 mg / kg kehakaalu kohta minutis iga 10-15 minuti järel, kuni saavutatakse soovitud terapeutiline toime. Maksimaalne annus on 0,3 mg / kg kehakaalu kohta minutis. Esmolool on klassifitseeritud ultraks lühinäitlemine ja pärast infusiooni lõpetamist mõne minuti pärast selle toime lakkab. Ebastabiilse hemodünaamika korral peetakse esmolooli valitud ravimiks.
β-blokaatorite annustamise põhimõte seisneb väikeste annuste esmane määramises, millele järgneb tiitrimine, kuni saavutatakse puhkeoleku pulsisagedus 50–60 minutis. Kui pulss on alla 45 minutis, tuleb β-blokaatori annust vähendada.
Südamepuudulikkusega ja vähenenud LV väljutusfraktsiooniga patsientidel on soovitatav kasutada selektiivset β-blokaatorit bisoprolooli (annuses 2,5-10 mg / päevas üks kord) ja karvedilooli, mis blokeerib α- ja β-adrenergilised retseptorid (annuses). 1,25-5 mg / päevas üks kord).
- β-blokaatorid on rasketel juhtudel vastunäidustatud bronhiaalastma, allergilised haigused, AV blokaad II-III aste, sino-kodade blokaad, siinusbradükardia, SBP alla 100 mm Hg, mõõdukas ja raske südamepuudulikkus, P-Q intervall üle 0,24 s, obstruktiivsed kopsuhaigused.
- AKE inhibiitorid on näidatud kõigile patsientidele, kellel on äge koronaarsündroom ST-segmendi elevatsiooniga koos eesmise müokardiinfarktiga, LV kontraktiilse funktsiooni märgatava langusega (väljaviskefraktsioon alla 40%), südamepuudulikkuse tunnustega, hüpertensiooniga, suhkurtõvega, korduva südameatakiga.
- Pikaajaline ravi AKE inhibiitoritega sellistel patsientidel vähendab see oluliselt suremust, korduva müokardiinfarkti riski ja südame dekompensatsiooni. Enamik eksperte peab vastunäidustuste puudumisel soovitavaks määrata AKE inhibiitorid kõigile ägeda koronaarsündroomiga patsientidele, kellel on ST tõus, vähemalt haiglaravi ajal.
- Alustage ravi lühitoimeliste ravimitega (kaptopriil 6-12 mg 3-4 korda päevas) või määrake toimeainet prolongeeritult vabastavad ravimid (ramipriil, lisinopriil, zofenopriil). Optimaalse terapeutilise toime saavutamiseks suurendatakse annust järk-järgult maksimaalse talutavuseni.
- AKE inhibiitorite ravi vastunäidustused on arteriaalne hüpotensioon (SBP alla 100 mm Hg), raske neerupuudulikkus, kahepoolne neeruarteri stenoos, individuaalne talumatus. AKE inhibiitorravi kõige sagedasemad kõrvalnähud on hüpotensioon ja kuiv köha.
- Angiotensiin II retseptori blokaatorid- alternatiiv AKE inhibiitoritele: need on ette nähtud AKE inhibiitorite talumatuse korral (tavaliselt köha tõttu). Näidustused on samad, mis AKE inhibiitoritel.
- Aldosterooni retseptori blokaatorid.
- Aldosterooni retseptori blokaatorid on näidustatud patsientidele, kellel on raske süstoolne düsfunktsioon(väljutusfraktsioon alla 40%), kes vajavad pidevat ravi diureetikumidega. Kasutatakse spironolaktooni (annuses 25-100 mg / päevas).
- Aldosterooni retseptori blokaatorid on vastunäidustatud raske neerupuudulikkuse, hüperkaleemia (üle 5 mmol / l) korral. Ravi ajal on hüperkaleemia oht, seetõttu on vajalik selle elektrolüüdi kontsentratsiooni hoolikas jälgimine veres.
- Statiinid. ST-segmendi elevatsiooniga ägeda koronaarsündroomiga patsientidele määratakse haiglaravi ajal lipiidide taset langetav ravi statiinidega. Vere lipiidide sisalduse algväärtuste jaoks võetakse haiguse esimesel päeval saadud näitajad, kuna järgmistel päevadel võib kolesterooli kontsentratsioon arenenud MI tõttu väheneda. Üldkolesterooli sihtsisaldus on tunduvalt alla 4 mmol / l (160 mg / dl) ja LDL - 2,6 mmol / l (100 mg / dl). On näidatud, et LDL-i kontsentratsiooni langusega 1,8 mmol / l (70 mg / dl) kaasneb prognoosi täiendav paranemine. Suures uuringus seostati atorvastatiini suurtes annustes (80 mg päevas) kardiovaskulaarse riski vähenemist 16% võrreldes standardannustega (40 mg pravastatiini).
Šahnovitš R.M.
Äge koronaarsündroom
Tsiteerimiseks: Novikova N.A., Giljarov M.Yu. Antitrombootiline ravi ägeda koronaarsündroomi korral ST-segmendi tõusuga // BC. 2008. nr 11. S. 1616
Praegu käsitletakse ägeda koronaarsündroomi (ACS) esinemist tavaliselt aterotromboosi mõiste raames. Selle seisundi patogenees on seotud ebastabiilse aterosklerootilise naastu moodustumisega, selle järgneva rebendiga ja trombi moodustumisega haavandilisele pinnale, ummistades veresoone valendiku. Koronaarangiograafia järgi avastatakse arteriaalne tromboos enam kui 90% ST segmendi elevatsiooniga ACS-i juhtudest. Need andmed määravad kindlaks hemostaatilist süsteemi mõjutavate ainete olulise rolli müokardiinfarktiga patsientide ravis.
Trombolüütilised ravimid
Müokardiinfarkti (MI) trombolüütilise ravi (TLT) kasutamise kogemus ulatub peaaegu poole sajandi taha. 1958. aastal manustati A. P. Fletcher esimesena edukalt streptokinaasi MI-ga patsiendile. Edasised uuringud on näidanud selle terapeutilise lähenemisviisi eeliseid paljudel patsientidel.
Praegu kasutatavad TLT ravimid ei hävita otseselt fibriini trombi, vaid mõjutavad seda fibrinolüüsi füsioloogilise süsteemi kaudu (joonis 1). See süsteem lagundab lahustumatu fibriini ahelad lahustuvateks fragmentideks, mis viib trombi lüüsini. Fibrinolüüsi füsioloogilist protsessi käivitavad kudede plasminogeeni aktivaatorid, mida sekreteerivad endoteelirakud. Plasminogeeni aktivaatorid muudavad plasminogeeni plasmiiniks – valguks, mis hüdrolüüsi teel fibriini otseselt lagundab. Lisaks fibriinile on plasmiin võimeline hävitama ka teisi vere hüübimissüsteemi komponente, nagu fibrinogeen, V, VIII ja XII faktorid ning protrombiin. Seetõttu plasmiini taseme tõus mitte ainult ei lüüsi trombi, vaid aeglustab ka trombide teket.
Trombolüütilised ravimid mõjutavad fibrinolüüsi süsteemi erinevate mehhanismide kaudu. Niisiis moodustab streptokinaas plasminogeeniga kompleksi, mille tulemusena avaneb selle aktiivne sait. See koht hõlbustab teiste plasminogeeni molekulide ülekandmist plasmiinile. See toob kaasa streptokinaasi-plasmiini komplekside ilmnemise, mis on resistentsed a2-antiplasmiini neutraliseeriva toime suhtes ja põhjustavad fibrinolüütilist toimet. Sel juhul aktiveerib streptokinaasi-plasminogeeni kompleks ligikaudu võrdselt nii veres ringlevaid fibriini trombiga seotud kui ka vaba plasminogeeni molekule.
Erinevalt streptokinaasist on rekombinantsed koeplasminogeeni aktivaatorid fibriinispetsiifilised ained, st nad soodustavad otseselt fibriiniga seotud plasminogeeni üleminekut plasmiiniks, lõhustades peptiidsideme.
Praegu on siseturul saadaval neli trombolüütilist ravimit: streptokinaas, prourokinaas, alteplaas ja tenekteplaas.
Streptokinaas
Streptokinaas on otsene plasminogeeni aktivaator. See on üheahelaline polüpeptiid, mis ei sisalda süsivesikuid, molekulmassiga 47 000 D, mis on toodetud b-hemolüütilise rühma C streptokoki kultuurist.
Streptokinaasi poolväärtusaeg on 15-25 minutit. Streptokinaas saadakse bakterite kultuurist, mille tulemusena on sellel antigeensed omadused. Inimese veres leidub alati streptokinaasivastaseid antikehi, mis on seotud streptokokkinfektsioonide suure levimusega elanikkonnas. Antistreptokinaasi antikehade tiitrid tõusevad kiiresti mõne päeva jooksul pärast manustamist ja saavutavad haripunkti mõne nädala jooksul. See tipp võib olla 1000 korda suurem streptokinaasivastaste antikehade algtasemest. Mõnel patsiendil taastuvad streptokinaasivastaste antikehade tiitrid algtasemele (enne selle manustamist) 6 kuu pärast, kuid paljudel juhtudel jäävad nende antikehade tiitrid kõrgele patsientidel, kes said streptokinaasi 2–4 aastat tagasi, põhjustades resistentsust uuesti tutvustus ravim, samuti allergilised reaktsioonid.
Ägeda müokardiinfarkti ravis määratakse streptokinaas tavaliselt annuses 1 500 000 U, mis lahjendatakse 100 ml isotoonilises naatriumkloriidi lahuses või 5% glükoosilahuses ja süstitakse 60 minuti jooksul. 1 500 000 U ravimi kiirema kasutuselevõtuga (30 minutiga) suureneb trombolüütilise ravi efektiivsus, mida hinnatakse infarktiga seotud koronaararteri avatuse sagedusega, kuid hüpotensiooni risk suureneb oluliselt.
Streptokinaasi efektiivsus on tõestatud mitmes randomiseeritud uuringus (GISSI-1, ISAM, ISIS-2 ja EMERAS). Fibrinolytic Therapy Trialists Collaborative Groupi metaanalüüsi kohaselt säästab streptokinaasi kasutamine esimese 6 tunni jooksul pärast müokardiinfarkti tekkimist 30 elu 1000 patsiendi kohta ja kui ravimit manustatakse 7–12 tunni jooksul, siis 20 elu. 1000 patsiendi kohta.
Prourokinaas
Prourokinaasil ehk üheahelalisel urokinaasi tüüpi plasminogeeni aktivaatoril on kõrge spetsiifilisus fibriiniga seotud plasminogeeni suhtes (võrreldes strepto- ja urokinaasiga), samuti pikem poolväärtusaeg. Pro-urokinaas aktiveerib valdavalt fibriiniga seotud plasminogeeni, millel on tsirkuleerivast plasminogeenist erinev konformatsioon.
Esimese aruande prouurokinaasi kasutamise kohta inimestel koostas Van de Werf 1986. aastal. Järgnevatel aastatel viidi läbi mitmeid suuri kliinilisi uuringuid ravimiga, mis saadi geenitehnoloogia meetoditel, kasutades natiivset prourokinaasi molekuli – sarupaasi (PASS). , SESAM, COMPASS), mis näitasid võrreldavat r-tPA efektiivsusega.
Alteplaza
Kudede plasminogeeni aktivaator (TAP), alteplaas on seriinproteaas molekulmassiga 72 000 D, mida sünteesivad peamiselt veresoonte endoteelirakud. TAP eritub vereringesse üheahelalise molekulina (molekulmass 70 000 D), mis muundub plasmiini, trüpsiini, kallikreiini või vere hüübimissüsteemi faktori Xa toimel kaheahelaliseks molekuliks. TAP-i ainulaadne omadus on selle väga kõrge selektiivsus fibriiniga seotud plasminogeeni suhtes, mis tagab selle eelistatud aktiveerimise fibriini trombi pinnal. Tõsi, see selektiivsus kaob suuresti, kui TAP-i kasutatakse terapeutilistes annustes.
TAP-il ei ole antigeenseid omadusi ja see ei mõjuta oluliselt hemodünaamikat; pürogeensed ja allergilised reaktsioonid vastuseks TAP-i manustamisele on haruldased. Sest kliiniline kasutamine TAP toodetakse DNA rekombinantse meetodiga.
Ägeda müokardiinfarkti raviks määratakse alteplaas tavaliselt 100–150 mg koguannuses 3 tunni jooksul, kusjuures esimesed 6–10 mg ravimit manustatakse boolusena 2 minuti jooksul. Kuna alteplaas koguannuses 150 mg põhjustas sageli hemorraagilisi tüsistusi ja liiga hiline 3-tunnine infusioon viis infarktiga seotud koronaararteri rekanalisatsioonini, on viimastel aastatel välja töötatud kaks uut rekombinantse TAP-i manustamisskeemi. on välja pakutud.
K. Neuhaus et al. (1989) pakkusid välja rekombinantse TAP-i "kiirendatud" manustamise skeemi: 100 mg 90 minuti jooksul, kusjuures esimesed 15 mg ravimit manustatakse boolusena, seejärel alustatakse infusiooni (50 mg 30 minuti jooksul ja 35 mg järelejäänud 60 minutit) ...
Teise skeemi alteplaasi manustamiseks müokardiinfarkti ägedal perioodil pakkusid välja J. Puruis et al. (1994): ravimit manustatakse kahe 50 mg boolusena 30-minutilise intervalliga booluste vahel. Rekombinantse TAP-i manustamise bipolaarse režiimi korral täheldati infarktiga seotud koronaararteri 90-minutilist avatust 78-l 84-st (93%) patsiendist ja täielikku avatust 88% juhtudest.
Kell võrdlev hindamine streptokinaasi ja alteplaasi efektiivsus GUSTO-I uuringus, milles osales enam kui 41 tuhat patsienti, näitas, et alteplaasi kasutamisel oli 30-päevane suremus 14% madalam ja hemorraagiliste insultide esinemissagedus veidi suurem.
Tenekteplaza
Rekombinantse DNA tehnoloogia abil saadud ravim tenekteplaas on teadlaste edukaim katse parandada inimese loomulikku TAP-i, muutes komplementaarse DNA molekuli erinevate piirkondade struktuuri. Struktuursete modifikatsioonide tulemusena saadi molekul, millel on pikem poolväärtusaeg plasmas, suurenenud spetsiifilisus fibriini suhtes ja suurem resistentsus esimest tüüpi plasminogeeni aktivaatori inhibiitori (PAI-1) suhtes võrreldes loodusliku TAP-ga.
1999. aastal avaldatud mitmekeskuseliste randomiseeritud uuringute ASSENT-I ja ASSENT-II tulemused näitasid, et mõlemad trombolüütilised ained on müokardiinfarkti (MI) patsientidel kasutamisel samaväärselt tõhusad. Tenekteplaasi vaieldamatu eelis selle kategooria patsientide puhul on ravimi parem ohutusprofiil ja selle ühekordse boolusena manustamise võimalus.
TLT efektiivsus sõltub tugevalt selle alguse ajast. Nekroosi tsooni laienemine müokardiinfarkti korral kasvab nagu laviin, seetõttu on nii tõsi väide: "Aeg on müokard." Suurim arv elusid on võimalik päästa TLT alguses 1 tunni jooksul pärast MI sümptomite ilmnemist, mistõttu on eriti oluline trombolüüs haiglaeelses staadiumis.
Atsetüülsalitsüülhape
ja klopidogreel
Atsetüülsalitsüülhape (ASA) pärsib trombotsüütide agregatsiooni, inhibeerides tsüklooksügenaasi ja vähendades tromboksaan A2 sünteesi. Tänapäeval on ASA efektiivsus ST-segmendi elevatsiooniga ACS-ga patsientidel väljaspool kahtlust. ISIS-2 uuringu kohaselt vähendas ASA manustamine suhtelist surmariski 23% ja kombinatsioonis trombolüütilise raviga streptokinaasiga - 42%. Tuleb märkida, et ASA-l oli eraldi manustatuna sama tõhusus kui streptokinaasil (joonis 2).
Roux S. jt metaanalüüsi kohaselt vähendab ASA määramine pärast trombolüütilist ravi reoklusiooni riski (11% ASA rühmas ja 25% ilma selleta, p.<0,001), частоту повторных эпизодов ишемии (25 и 41% соответственно, р<0,001). Эффект АСК был одинаковым как при проведении тромболитической терапии стрептокиназой, так и альтеплазой .
Teine metaanalüüs näitas, et ASA kasutamine sekundaarse ennetuse vahendina võib vähendada korduva müokardiinfarkti, insuldi ja kardiovaskulaarse surma riski 25% võrra.
Praegu võib pidada tõestatuks (ja see kajastub ACS-i ravi soovitustes), et ASA-d tuleb määrata kõigile MI-ga patsientidele, kellel ei ole vastunäidustusi. Soovitatav on närida ASA-d annuses 160-325 mg. Tulevikus määratakse ravim annuses 75-325 mg päevas. ...
Klopidogreel blokeerib selektiivselt ja pöördumatult ADP seondumist trombotsüütide retseptoritega, inhibeerib nende aktivatsiooni, vähendab toimivate ADP retseptorite arvu (kahjustusteta), takistab fibrinogeeni sorptsiooni ja pärsib trombotsüütide agregatsiooni. Klopidogreel on eelravim, mis biotransformeerub maksas aktiivse metaboliidi moodustumisega.
ST-segmendi elevatsiooniga ACS diagnoosimise ja ravi soovitustes kaaluti klopidogreeli määramist alternatiivina ASA-le selle talumatuse korral. Kuid pärast nende soovituste avaldamist on läbi viidud kaks suurt uuringut: COMMIT-CCS-2 ja CLARITY-TIMI-28, milles hinnati kahekordse antitrombootilise ravi (ASA + klopidogreel) efektiivsust ST-segmendi elevatsiooniga ACS-ga patsientidel.
COMMIT-CCS-2 uuringus osales 45852 patsienti, kes said lisaks põhiravile ASA-d 162 mg päevas. 75 mg klopidogreeli (ilma küllastusannuseta) keskmiselt 14,9 päeva jooksul. Surma, korduva MI ja insuldi kombineeritud lõpp-punkti esinemissagedus oli platseeborühmas 10,1% ja klopidogreeli rühmas 9,2% (RR 0,91; 95% CI 0,86–0,97; p = 0,002). Klopidogreeli rühmas täheldati ka üldise suremuse vähenemist (vastavalt 7,5% ja 8,1%, p = 0,03). Koljusisese hemorraagia ja verejooksu esinemissagedus oluliselt ei erinenud (0,55% platseeborühmas ja 0,58% klopidogreeli rühmas; p = 0,59). Klopidogreeli määramise mõju täheldati sõltumata trombolüütilise ravi läbiviimisest.
Uuring CLARITY-TIMI-28 hõlmas 3491 patsienti. Klopidogreeli manustati ühekordse annusena 300 mg, millele järgnes 75 mg päevas. Esmane tulemusnäitaja hõlmas infarktiga seotud arteri CAG-i oklusiooni, surma ja korduvat müokardiinfarkti. Klopidogreeli rühmas oli esmase tulemusnäitaja esinemissagedus 15%, platseeborühmas - 21,7% (OR 0,64; 95% CI 0,53-0,76; p<0,001). Следует отметить, что в исследование не включались пациенты, получившие дозу гепарина более 4000 ед. .
Nende uuringute andmed eeldasid olemasolevate soovituste muutmist ST-segmendi elevatsiooniga ACS-iga patsientide diagnoosimiseks ja raviks ning nende muudatused avaldati 2007. aastal.
Praegu määratakse klopidogreel annuses 75 mg päevas. soovitatav kõigile ST-segmendi elevatsiooniga ACS-ga patsientidele vähemalt 14 päeva jooksul, olenemata sellest, kas trombolüütilist ravi viidi läbi või mitte (I klass, tase A). Alla 75-aastastele patsientidele, sõltumata trombolüütilisest ravist, on soovitatav määrata klopidogreeli küllastusannus 300 mg (klass IIa, tase C). Pikaajaline ravi klopidogreeliga (aasta jooksul) on soovitatav ST-segmendi elevatsiooniga ACS-ga patsientidel, sõltumata reperfusioonravist (klass IIa, tase C).
Varfariin
Varfariini kasutamise ajalugu müokardiinfarkti korral on rohkem kui 50 aastat. Veel 1956. aastal kirjutati see ravim välja USA presidendile D. Eisenhowerile.
Sellegipoolest on isegi tänapäeval vaieldavad näidustused varfariini pikaajaliseks määramiseks patsientidele pärast ACS-i ST-segmendi elevatsiooniga.
Kombineeritud ravi kasutamine väikeses annuses varfariiniga (INR<2,0) и низкими дозами АСК не влияло на частоту комбинированной конечной точки (смерть, повторный ИМ, инсульт). В исследование CARS было включено 8803 пациента, которые были раз-де-лены на 3 группы: получавшие 160 мг/сутки АСК, раз-лучавшие 3 мг/сут. варфарина + 80 мг/сутки АСК и получавшие 1 мг/сут. варфарина + 80 мг/сутки АСК. Средний срок наблюдения составил 14 месяцев. По результатам исследования не было получено преимуществ от добавления фиксированных низких доз варфарина к стандартной терапии АСК. Частота первичной конечной точ-ки составила 8,6, 8,4 и 8,8% соответственно .
LoWASA uuringus said 1659 patsienti 1,25 mg varfariini päevas + 75 mg ASA-d. Kontrollrühma, mis sai ASA-d annuses 75 mg / päevas, kuulus 1641 patsienti. Vaatlusperiood oli 5 aastat. Ja selles uuringus ei põhjustanud varfariini väikeste annuste lisamine kombineeritud tulemusnäitaja (surm, korduv müokardiinfarkt, insult) esinemissageduse vähenemist, mis oli vastavalt 28,1% ja 28,8%.
Mõõduka kuni jõulise antikoagulatsiooniga saadi palju julgustavamaid tulemusi. Uuringus APRICOT II, kui varfariini määrati kuni INR-ni 2,0–3,0 kombinatsioonis 80 mg ASA-ga võrreldes 80 mg ASA-ga, täheldati reoklusioonide väiksemat esinemissagedust (15 versus 28%, p.<0,02) и на 23% (р<0,01) снижение относительного риска возникновения комбинированной конечной точки, включавшей смерть, ИМ и реваскуляризацию в группе пациентов, получавших комбинированную терапию .
WARIS II uuringus osales 3630 patsienti, kes jagati 3 rühma: kes said varfariini kuni INR 2,8-4,2, varfariini kuni INR 2,0-2,5 + ASA 75 mg ja 160 mg ASA. Vaatlusperiood oli 4 aastat. Võrreldes ASA-ga vähenes 1. rühma patsientidel kombineeritud tulemusnäitaja, mis hõlmas surma, müokardiinfarkti ja emboolilist insulti, suhteline risk 19% (p = 0,001) ja 2. rühma patsientidel 29% (p = 0 , 03). Samal ajal ei esinenud erinevusi ellujäämises ning eelis saavutati MI ja insultide esinemissageduse vähenemise tõttu. Lisaks oli varfariini rühmas suurem verejooksude esinemissagedus ja umbes 35% patsientidest lõpetas varfariini võtmise.
ASPECT-uuringul oli sarnane ülesehitus ja võrreldavad tulemused. Kombineeritud tulemusnäitaja (surm, MI, insult) sagedus kõrge intensiivsusega antikoagulatsiooni (INR 3,0-4,0) rühmas oli 5%, kombineeritud ravi rühmas (INR 2,0-2,5 + ASA 81 mg) - 5%. ja ASA 81 mg rühmas - 9%. Siiski oli kombineeritud ravi rühmas kõige suurem kergete verejooksude esinemissagedus (suure verejooksu esinemissagedus rühmade vahel ei erinenud). Samal ajal lõpetas 20% patsientidest varfariini võtmise ja ainult 40%-l oli antikoagulantide sihttase.
Kuigi ülaltoodud uuringutes osutus mõõduka intensiivsusega antikoagulantravi varfariiniga kombinatsioonis ASA-ga efektiivseks korduva müokardiinfarkti ja insuldi riski vähendamisel, saavutati see verejooksude sageduse suurenemisega. Lisaks saadi tulemusi alla 75-aastaste patsientide seas. Teine probleem oli varfariini kõrge ärajätmise määr ja INR-i sihtväärtuste saavutamise raskus.
Praegu peetakse varfariini määramist ägeda müokardiinfarkti korral sobivaks ainult patsientidel, kellel on kõrge trombembooliliste tüsistuste risk: suurte südameinfarktidega, intrakardiaalse tromboosi esinemisega, trombemboolia episoodidega kopsu- ja kopsuvereringes, nende juuresolekul. kodade virvendusarütmia ja alajäsemete süvaveenide tromboosiga patsientidel. Nende riskiteguritega patsientidel pärast hepariinravi soovitatakse jätkata ravi varfariiniga kogu haiglas viibimise ajal. Intrakardiaalse trombi olemasolul soovitatakse varfariinravi jätkata vähemalt 3 kuud. Püsiva kodade virvenduse korral tuleb varfariini võtta pidevalt. Soovitatav on hoida INR-i tasemel 2,0–3,0.
Fraktsioneerimata hepariin
Trombi moodustumine ebastabiilse naastu pinnal mängib ACS-i patogeneesis võtmerolli. Trombolüütiline ravi eemaldab arteri oklusiooni trombi lahustades, kuid see ei mõjuta trombi uuesti moodustumist ja seetõttu on vaatamata edukale trombolüüsile suur tõenäosus sihtsoone uuesti oklusiooniks.
Fraktsioneerimata hepariini (UFH) on MI ravis kasutatud üle 40 aasta. Trombolüütilist ravi saavatel patsientidel sõltub UFH kasutamine kasutatava ravimi tüübist. Mittespetsiifilised trombolüütilised ravimid (streptokinaas, antistreplaas ja urokinaas) vähendavad hüübimispotentsiaali, vähendades V ja VIII faktorite kontsentratsiooni ja suurte fibriini lagunemissaaduste moodustumist. Seetõttu ei ole vajadus antikoagulantide täiendava väljakirjutamise järele nende kasutamise ajal nii ilmne.
Neid teoreetilisi kaalutlusi toetavad tõendid uuringutest, mis ei ole näidanud UFH lisamisest olulist kasu. Vastavalt Collinsi jt metaanalüüsile. hepariini väljakirjutamine pärast süsteemset trombolüüsi streptokinaasiga võimaldab päästa 5 elu 1000 ravitud patsiendi kohta hinnaga 3 veritsust 1000 patsiendi kohta. Kuigi erinevus oli statistiliselt oluline, oli puhasmõju väike. Seetõttu on praeguste soovituste kohaselt UFH määramine pärast streptokinaasiga trombolüüsi näidustatud ainult patsientidel, kellel on kõrge trombembooliliste komplikatsioonide risk (laiaulatusliku eesmise müokardiinfarkti, kodade virvenduse, trombemboolia anamneesis või intrakardiaalse trombi olemasoluga) .
Erinevalt streptokinaasist on fibriinispetsiifilistel ravimitel (alteplaas ja tenekteplaas) süsteemsele koagulatsioonile kord-vähem väljendunud mõju ning pärast nende kasutamist on vaja antikoagulante. UFH-ravi algab boolusannusega 60 ühikut/kg (kuid mitte rohkem kui 4000 ühikut), millele järgneb infusioon 12 ühikut/kg/tunnis (kuid mitte rohkem kui 1000 ühikut tunnis) kuni aktiveeritud osalise tromboplastiini aja (APTT) saavutamiseni. suureneb algväärtusest 1 , 5-2 korda (kuni umbes 50-70 s). Infusiooni kestus on vähemalt 48 tundi.
Bivalirudiini võib alternatiivina kasutada hepariini talumatuse või hepariinist põhjustatud trombotsütopeenia tekkimisel, kuid see ravim on väga kallis ja seda pole meie riigis saadaval.
Madala molekulmassiga hepariinid
ja fondapariinuks
Pikaajalise intravenoosse infusiooni ja APTT sagedase jälgimise vajadus muudab UFH kasutamise üsna ebamugavaks. Madala molekulmassiga hepariinidel (LMWH) need puudused puuduvad. Praegu on UFH alternatiivina tehtud ettepanek kasutada revipariini ja enoksapariini või Xa faktori sünteetilist inhibiitorit fondapariinuksi. Viimased kaks ravimit on meie riigis saadaval. Andmed ravimite efektiivsuse ja ohutuse kohta on toodud tabelis 1.
Pärast trombolüüsi määrati enoksapariin, võttes arvesse patsiendi vanust ja kreatiniini kliirensit. Pa-tsi-en-tami vähem kui 75 aasta jooksul määrati ravim intravenoosse boolusena 30 mg, millele järgnes subkutaanne manustamine 1 mg / kg (mitte rohkem kui 120 mg) 2 korda päevas. Üle 75-aastastele isikutele määrati ravim ainult subkutaanselt ja vähendatud annuses (0,75 mg / kg) 2 korda päevas. Kreatiniini kliirensi vähenemisega manustati enoksapariini annuses 1 mg / kg üks kord päevas. Kõrgenenud kreatiniinisisaldusega patsientidele (meestel üle 2,5 mg% ja naistel üle 2,0 mg%) enoksapariini ei määrata.
Fondapariinuks määratakse patsientidele, kelle kreatiniinisisaldus on alla 3,0 mg% annuses 2,5 mg IV, millele järgneb 2,5 mg subkutaanne manustamine üks kord päevas. Enoksapariini ja fondapariinuksi ravi kestus on 2 kuni 8 päeva. Mõlemat ravimit soovitatakse kasutada ACC / AHA juhiste viimases versioonis, millel on kõrgeim tõendusaste ja tase (IA).
Mõlemad ravimid on näidustatud ST-segmendi elevatsiooniga ACS-ga patsientidele ja trombolüütilise ravi puudumisel.
IIb / IIIa retseptorite inhibiitorid
trombotsüüdid
Sellel ravimite rühmal, nagu on näidatud mitmetes uuringutes, puudub reperfusiooni aktiivsus. Kuid neid saab kasutada koos fibriini spetsiifiliste trombolüütikumidega ja viimaseid kasutatakse poole annusena. Seega võrreldi GUSTO-V uuringus reteplaasi täisannuse ja kombineeritud ravi kasutamist reteplaasi poole annuse ja abtsiksimabi täisannuse vormis esimese 6 tunni jooksul pärast MI väljakujunemist. Suremus ei erinenud oluliselt kummaski alarühmas (vastavalt 5,6% ja 5,9%), kuid kombinatsioonravi rühmas esines korduvaid südameinfarkti ja müokardiinfarkti tüsistusi vähem. Samas suurenes verejooksude sagedus kombineeritud ravi kasutamisel oluliselt (4,6 versus 2,3%; p = 0,001), eriti üle 75-aastaste patsientide rühmas. Samas vanuserühmas suurenes ka intrakraniaalsete hemorraagiate esinemissagedus. Sarnased tulemused saadi ASSENT-3 uuringus ab-cic-simabi kombinatsiooniga poole annusega tenekteplaasiga. Seega on sellisel lähenemisel õigus eksisteerida alla 75-aastastel inimestel, eriti neil, kes plaanivad teha perkutaanset koronaarset sekkumist.
Meie riigis pole IIb / IIIa retseptorite välismaiseid inhibiitoreid, kuid sellest rühmast on kodumaine ravim - monofram, mille on välja töötanud RKNPK spetsialistid. Praegu puuduvad andmed monoframi ja trombolüütikumide kombineeritud kasutamise kohta, kuid on teada, et ravim on kõrge riskiga patsientidel näidanud kõrget efektiivsust pärgarterite perkutaansete sekkumiste läbiviimisel.
Järeldus
Viimastel aastatel on antitrombootiline ravi ST-segmendi elevatsiooniga ACS-ga patsientidel muutunud üha agressiivsemaks. Tienopüridiinid, LMWH ja fondapariinuks on praeguses kliinilises praktikas kasutusele võetud kui kohustuslikud trombolüütilised ained. Intrakoronaarsete sekkumiste arv kasvab, mis nõuab antitrombootilise ravi eriskeeme. Samas on meil veel vähe kasutatud trombolüütilist ravi, mis müokardiinfarkti algperioodil on efektiivsuselt võrreldav angioplastikaga.
Mitte kaugel on uute hemostaasi mõjutavate ainete – prasugreeli, indraparinuksi ja võimalik, et ka otsese trombiini inhibiitori, eelkõige dabigatraani – ilmumine turule. Võimalik on ka suukaudsete Xa faktori inhibiitorite – rivaroksabaani ja apiksabaani – kasutuselevõtt. Nende tõhusust ja ohutust käsitletakse eelseisvates kliinilistes uuringutes.


Kirjandus
1. ACC/AHA juhised ST-elevatsiooniga müokardiinfarktiga patsientide raviks. Tiraaž, 2004, 110: e82-292.
2. Fibrinolüütilise ravi näidustused ägeda müokardiinfarkti kahtluse korral: varajase suremuse ja suurema haigestumuse ühisülevaade tulemused kõigist enam kui 1000 patsiendiga randomiseeritud uuringutest. Fibrinolüütilise ravi katsetajate (FTT) koostöörühm. Lancet 1994; 343: 311-322.
3. GUSTO uurijad. Rahvusvaheline randomiseeritud uuring, milles võrreldakse nelja ägeda müokardiinfarkti trombolüütilist strateegiat N. Engl. J. Med., 1993; 329: 673-682.
4. Menon V., Harrington R.A. et al. Trombolüüs ja täiendav ravi ägeda müokardiinfarkti korral. Rind 2004; 126 549S-575S.
5. ISIS-2 koostöörühm. Randomiseeritud uuring intravenoosse streptokinaasi, suukaudse aspiriini, mõlema või mitte kummagi 17 187 ägeda müokardiinfarkti kahtluse hulgas: ISIS-2. Lancet, 1988, 2: 349-360.
6. Roux S. et al. Aspiriini mõju koronaararterite reoklusioonile ja korduvale isheemiale pärast trombolüüsi: metaanalüüs J Am Coll Cardiol, 1992; 19: 671-677.
7. Tromboosivastaste katsetajate koostöö. Trombotsüütide agregatsioonivastase ravi randomiseeritud uuringute koostöö metaanalüüs surma, müokardiinfarkti ja insuldi ennetamiseks kõrge riskiga patsientidel. BMJ, 2002, 324, 71-86.
8. Chen ZM, Jiang LX, Chen YP jt. Klopidogreeli lisamine aspiriinile 45 852 ägeda müokardiinfarktiga patsiendil: randomiseeritud platseebokontrollitud uuring. Lancet, 2005; 366: 1607-1621.
9. Sabatine MS, Cannon CP, Gibson CM jt. Klopidogreeli lisamine aspiriinile ja fibrinolüütilisele ravile ST-segmendi tõusuga müokardiinfarkti korral. N Engl J Med., 2005; 352: 1179-1189.
10.2007 ACC / AHA 2004. aasta juhiste keskendunud uuendus ST-elevatsiooniga müokardiinfarktiga patsientide raviks. Tiraaž, 2008; 117: 296-329.
11. Coumadin Aspirin Reinfarction Study (CARS) uurijad Randomiseeritud topeltpime uuring fikseeritud väikeses annuses varfariini ja aspiriiniga pärast müokardiinfarkti. Lancet, 1997; 350: 389-396
12. Herlitz J. et. al. Aspiriinile lisatud väikeses annuses fikseeritud varfariini toime pikaajaliselt pärast ägedat müokardiinfarkti. Eur. Heart J., 2004; 25: 232-239.
13. Brouwer MA, van den Bergh PJ, Aengevaeren WR et al. Aspiriin pluss kumariin versus aspiriin üksi reoklusiooni ennetamisel pärast fibrinolüüsi ägeda müokardiinfarkti korral: antitrombootiliste ainete tulemused koronaartrombolüüsi reoklusiooni ennetamisel (APRICOT) -2 katse. Circulation 2002, 106: 659-65.
14. Hurlen M, Abdelnoor M, Smith P, Erikssen J, Arnesen H. Varfariin, aspiriin või mõlemad pärast müokardiinfarkti. N Engl, J. Med, 2002, 347: 969-74.
15.van Es RF, Jonker JJ, Verheugt FW, Deckers JW, Grobbee DE antitrombootikumide uurimiseks koronaartromboosi-2 sündmuste sekundaarses ennetamises (ASPECT-2) uurimisrühm. Aspiriin ja kumadiin pärast ägedaid koronaarsündroome (uuring ASPECT-2): randomiseeritud kontrollitud uuring. Lancet, 2002; 360: 109-113.
16. Collins R, Peto R, Baigent C, Sleight P. Aspiriin, hepariin ja fibrinolüütiline ravi kahtlustatava ägeda müokardiinfarkti korral. N Engl, J Med., 1997, 336: 847-860.