Munasarjade hüperandrogenism. Neerupealiste hüperandrogenism naistel: haiguse peamised aspektid ja haiguse ravimeetodid. Kampaaniad ja eripakkumised
Vastassoost omaste väljendunud iseloomulike tunnuste patoloogiline ilming inimesel kutsub sageli esile neerupealiste hüperandrogeensuse (adrenogenitaalne sündroom). Selle sündroomi arenguga organismis on suurenenud sisu androgeenid (steroidsed meessuguhormoonid), mis põhjustavad virilisatsiooni.
Üldine informatsioon
Neerupealiste geneesi virilisatsioon (maskulinisatsioon) on põhjustatud androgeensete hormoonide liigsest tootmisest neerupealiste poolt ning see toob kaasa välised ja sisemised muutused, mis on patsiendi soole ebatüüpilised. Androgeenid on täiskasvanud naise kehas hädavajalikud, kuna nad vastutavad oluliste muutuste eest kehas puberteedieas. Eelkõige toodavad nad östrogeeni sünteesi ning aitavad kaasa ka luukoe tugevdamisele, lihaste kasvule, osalevad maksa ja neerude reguleerimises ning reproduktiivsüsteemi moodustamises. Androgeene toodavad peamiselt neerupealised ja naise keha munasarjad ja meestel munandid. Nende hormoonide sisalduse normi märkimisväärne ületamine naistel võib oluliselt häirida reproduktiivsüsteemi ja isegi põhjustada viljatust.
Neerupealiste hüperandrogenismi põhjused
 Hormonaalne tasakaalutus võib põhjustada haigusi.
Hormonaalne tasakaalutus võib põhjustada haigusi. Androgeenide organismis kuhjumise peamiseks põhjuseks on ensüümide sünteesi kaasasündinud defekt, mis takistab steroidide muundumist. Kõige sagedamini on sellise defekti rolliks glükokortikoide sünteesiva C21-hüdroksülaasi puudulikkus. Pealegi, hormonaalne tasakaalutus on neerupealiste koore hüperplaasia või kasvajataoliste moodustiste mõju tagajärg (mõned neerupealiste kasvajate tüübid on võimelised tootma hormoone). Kaasasündinud tüüpi neerupealiste hüperandrogenismi kõige sagedamini diagnoositud esinemine. Kuid mõnikord esineb androgeene sekreteerivatest neerupealiste kasvajatest tingitud hüperandrogenismi juhtumeid (Itsenko-Cushingi tõbi).
Patogenees
C21-hüdroksülaasi defitsiit suudab mõnda aega edukalt kompenseerida neerupealiste poolt ja läheb dekompenseeritud faasi hormonaalse tausta stressikõikumisega, mis on põhjustatud emotsionaalsetest murrangutest ja muutustest reproduktiivsüsteemis (seksuaalsuhete algus, Rasedus). Ensüümide sünteesi defekti ilmnemisel peatub androgeenide muundumine glükokortikoidideks ja toimub nende liigne kogunemine organismi.
Adrenogenitaalse sündroomi arengu tunnused naistel
Adrenogenitaalne sündroom naistel põhjustab tõsiseid muutusi munasarjade töös ja häireid reproduktiivsüsteemis. Statistiliste uuringute kohaselt kannatab iga viies naine teatud määral erinevate ilmingutega hüperandrogenismi all. Veelgi enam, vanus sel juhul ei oma tähtsust, haigus avaldub igal etapil eluring alates imikueast.
Hüperandrogenismi mõju munasarjade funktsioonile põhjustab järgmisi ilminguid:
- folliikulite kasvu ja arengu pärssimine follikulogeneesi varases faasis avaldub amenorröa (menstruatsiooni puudumine mitme tsükli jooksul);
- folliikuli ja ovulatsioonivõimetu munaraku kasvu ja arengu aeglustumine võib väljenduda anovulatsioonina (ovulatsiooni puudumine) ja oligomenorröana (perioodidevahelise intervalli pikenemine);
- ovulatsioon defektse kollaskehaga, väljendub tsükli luteaalfaasi puudumises isegi regulaarse menstruatsiooni korral.
Neerupealiste hüperandrogenismi sümptomid
 Näo juuksed suurenevad naistel koos neerupealiste hüperandrogenismiga.
Näo juuksed suurenevad naistel koos neerupealiste hüperandrogenismiga. Adrenogenitaalsel sündroomil on primaarsed ja sekundaarsed ilmingud, sõltuvalt haiguse arengufaasist ja selle esinemise teguritest. Kaudsed märgid neerupealiste hüperandrogenismi esinemine naistel on sagedane külmetushaigused, kalduvus depressioonile, suurenenud väsimus.
Neerupealiste hüperandrogenismi peamised sümptomid:
- suurenenud kasv juuksepiir(jäsemed, kõht, piimanäärmed), kuni hirsutismini (karvakasv põskedel);
- kiilaspäisus koos kiilakate laikude moodustumisega (alopeetsia);
- naha defektid (akne, akne, koorimine ja muud põletikud);
- lihaste atroofia, osteoporoos.
Järgmised ilmingud on adrenogenitaalse sündroomi sekundaarsed sümptomid:
- arteriaalne hüpertensioon, mis väljendub krampide kujul;
- kõrgendatud tase vere glükoosisisaldus (2. tüüpi diabeet);
- kiire ülekaalulisus kuni rasvumiseni, vajab ravi;
- naiste suguelundite moodustumise vahepealne tüüp;
- menstruatsiooni puudumine või märkimisväärsed perioodid perioodide vahel;
- viljatus või raseduse katkemine (edukaks raseduseks on vajalik teatud hulk naissuguhormoone organismis, mille tootmine hüperandrogenismi korral praktiliselt peatub).
Tsiteerimiseks: A. A. Pištšulin, E. A. Karpova Munasarjade hüperandrogenism ja metaboolne sündroom // eKr. 2001. nr 2. Lk 93
Endokrinoloogiline teaduskeskus RAMS, Moskva
KOOS mittekasvajalise päritoluga munasarjade hüperandrogeensuse või munasarjade hüperandrogeense düsfunktsiooni indromo, mida varem nimetati Stein-Leventhali sündroomiks, on nüüd WHO klassifikatsiooni järgi maailmakirjanduses rohkem tuntud kui polütsüstiliste munasarjade sündroom (MAGA).
PCOS-i kliiniline pilt väljendub munasarjade kroonilises anovulatoorses seisundis või kollakeha raskes hüpofunktsioonis, mis põhjustab munasarjade suuruse kahepoolset suurenemist koos paksenemise ja albuginea skleroosiga. Need muutused väljenduvad menstruaaltsükli funktsiooni rikkumises - opsomenorröa, amenorröa, kuid metrorraagia areng pole välistatud. Follikulogeneesi häired põhjustavad anovulatoorse primaarse või sekundaarse viljatuse arengut.
Üks peamisi PCOS-i diagnostilisi kriteeriume on hüperandrogenism. - androgeensete steroidide (nagu testosteroon, androsteendioon) taseme tõus veres, mis põhjustab hirsutismi ja teiste androgeenist sõltuvate dermopaatiate tekke.
Rasvumine või ülekaalulisus on sageli seotud PCOS-iga. Kehamassiindeksi (KMI) määramine võimaldab teil tuvastada rasvumise astme. Talje (OT) ja puusade (OB) mahu näitajate ja nende suhte mõõtmine näitab rasvumise tüüpi (prognoosiliselt ebasoodne on kõhupiirkonna rasvumise tüüp, mille puhul OT / OB> 0,85).
Lisaks haiguse peamistele sümptomitele määrab kliinilise pildi suuresti üldine ainevahetushäired nagu düslipideemia, häire süsivesikute ainevahetus, suurenenud risk hüperplastiliste ja neoplastiliste protsesside tekkeks suguelunditest. Düslipideemia on triglütseriidide, kolesterooli, madala tihedusega lipoproteiinide, väga madala tihedusega lipoproteiinide sisalduse suurenemine ja kõrge tihedusega lipoproteiinide sisalduse vähenemine. Need häired põhjustavad aterosklerootiliste veresoonte muutuste varajase arengu riski, hüpertensioon ja isheemiline haigus südamed.
Süsivesikute metabolismi häired seisnevad insuliiniresistentsuse-hüperinsulineemia kompleksi väljatöötamises, millest on viimasel ajal saanud PCOS-i arengu patogeneetiliste seoste uurimise põhisuund.
60ndatel seostati PCOS-i patogeneesi munasarjade 19-hüdroksülaasi ja/või 3b-dehüdrogenaasi primaarse ensümaatilise defektiga, ühendades need häired primaarse polütsüstiliste munasarjade mõistega. Kuid järgnevate aastate töödes näidati, et granuloosrakkude aromataasi aktiivsus on FSH-sõltuv funktsioon.
PCOS-i korral ilmnenud luteiniseeriva hormooni (LH) taseme tõus, selle ovulatsiooni tipu puudumine, folliikuleid stimuleeriva hormooni (FSH) normaalne või vähenenud tase koos kahjustatud LH/FSH suhtega (2,5–3) viitasid esmasele rikkumisele. steroidogeneesi gonadotroopne regulatsioon munasarjakoes koos sekundaarse polütsüstiliste munasarjade haiguse tekkega.
Kuni 1980. aastate keskpaigani usuti (SSC jeeni teooria), et PCOS-i patogeneesi käivitav mehhanism on androgeenide liigne süntees neerupealiste poolt adrenarhe ajal, mis on tingitud neerupealiste tundlikkuse muutumisest ACTH suhtes või liigsest stimulatsioonist. võrkkesta neerupealise koore kahjustus mitte-ACTH-sarnase faktori poolt või b-endorfiinide, neurotransmitterite, näiteks dopamiini mõjul. Jõudes kriitiline mass kehas (eriti kui selle norm on ületatud), suureneb androgeenide perifeerne muundumine östrogeenideks, eelkõige maksas ja rasvkoes. Östrogeenide, peamiselt östrooni taseme tõus põhjustab gonadotroofide ülitundlikkust luliberiini (GnRH) suhtes. Samal ajal suureneb östrooni mõjul hüpotalamuse GnRH tootmine, suureneb selle sekretsiooniimpulsside amplituud ja sagedus, mille tulemusena suureneb LH tootmine adenohüpofüüsi poolt, LH / FSH suhe on häiritud ja tekib suhteline FSH defitsiit. LH toime tugevdamine munasarjadele aitab kaasa androgeenide tootmise suurenemisele tekaalsete rakkude poolt ja nende hüperplaasiale. Suhteliselt madal tase FSH viib FSH-sõltuva aromataasi aktiivsuse vähenemiseni ja granuloosrakud kaotavad võime androgeene aromataasi muuta östrogeenideks. Hüperandrogenism häirib folliikulite normaalset kasvu ja aitab kaasa nende tsüstilise atreesia tekkele. Folliikulite kasvu ja küpsemise puudumine pärsib veelgi FSH sekretsiooni. Suurenenud androgeenide kogum perifeersetes kudedes muundatakse östrooniks. Nõiaring sulgub.
Seega on steroidogeneesi reguleerimise kesk- ja perifeersete mehhanismide rikkumise tagajärg funktsionaalse munasarjade hüperandrogenismi tekkimine PCOS-iga patsientidel.
PCOS-i patogenees S.S.C. Jeen on näidatud joonisel 1:
Skeem 1.
80ndate alguses pakkusid mitmed autorid välja uue polütsüstiliste munasarjade sündroomi patogeneesi teooria, mis erineb S.S.C. jeen. On leitud, et PCOS on seotud hüperinsulineemiaga ja seda iseloomustavad nii reproduktiiv- kui metaboolsed düsfunktsioonid.
Hüperinsulinemia ja hüperandrogenismi vahelise seose olemasolule osutasid juba 1921. aastal Achard ja Thieris. Nad kirjeldasid hüperandrogeensust II tüüpi diabeediga rasvunud naisel ja nimetasid seda seisundit "habemega naiste diabeediks".
Hiljem avastas D. Bargen, et PCOS-i ja hüperandrogenismiga naistel oli basaal- ja glükoosist stimuleeritud hüperinsulineemia võrreldes sama kehakaaluga naiste kontrollrühmaga, mis viitas insuliiniresistentsuse olemasolule. Insuliini ja androgeeni taseme vahel oli otsene seos ning pakuti, et hüperinsulineemia võib olla hüperandrogenismi põhjus.
1988. aastal pakkus G. Reaven esimest korda välja, et metaboolsete häirete sündroomi kujunemisel mängivad suurt rolli IR ja kompenseeriv hüperinsulineemia (GI). Ta pani talle nime "Sündroom X" ... Praegu on kõige sagedamini kasutatav termin "metaboolne sündroom" või "insuliiniresistentsuse sündroom".
Hüpoteesid hüperinsulineemia ja hüperandrogenismi patogeneesist Hüperandrogenismi ja hüperinsulinemia tekkemehhanism ei ole täielikult teada. Teoreetiliselt on kolm võimalikku koostoimet: hüperandrogenism (GA) põhjustab GI; GI viib GA-ni: mõlema nähtuse eest vastutab mingi kolmas tegur.
1. Eeldus, et GA põhjustab GI, põhineb järgmistel faktidel. Naistel, kes võtavad suukaudseid rasestumisvastaseid vahendeid, mis sisaldavad "androgeensete omadustega" progestiine, on glükoositaluvus halvenenud. Pikaajalise testosterooni määramisega transseksuaalidele kaasneb IR esinemine. On näidatud, et androgeenid mõjutavad lihaskoe koostist, suurendades teist tüüpi lihaskiudude arvu, mis on insuliini suhtes vähem tundlikud kui esimest tüüpi kiud.
2. Enamik tegureid viitab sellele, et GI viib GA-ni. On näidatud, et IR püsib patsientidel, kellele tehti vahesumma või täielik munasarjade eemaldamine, samuti naistel, kes on pikka aega kasutanud GnRH agoniste, kui androgeenide tase oli selgelt alla surutud. Diasoksiidi, ravimi, mis pärsib kõhunäärme insuliini sekretsiooni, manustamine põhjustas PCOS-i, rasvumise ja hüperinsulineemiaga patsientidel testosterooni (T) taseme languse ja sugusteroide siduva globuliini (SSSH) taseme tõusu. Intravenoosne manustamine insuliin PCOS-iga naistel tõi kaasa tsirkuleeriva androsteendiooni ja T taseme tõusu. Insuliinitundlikkuse suurendamisele suunatud sekkumistega (kaalulangus, paastumine ja madala kalorsusega dieet) kaasnes androgeenide taseme langus. On tõendeid selle kohta, et insuliin võib otseselt pärssida CCH tootmist maksas ja hüperinsulinemia tingimustes see toime tugevneb. Samal ajal arvatakse, et CCSS-i sünteesi peamine regulaator on insuliin, mitte suguhormoonid. SHSS-i taseme langus põhjustab vaba ja seega ka bioloogiliselt aktiivse T kontsentratsiooni tõusu (tavaliselt on 98% T-st seotud olekus).
Hüpotees, mis seob HA-d hüperinsulinemiaga, ei vasta küsimusele, kuidas munasarjad säilitavad insuliinitundlikkuse, kui keha on insuliiniresistentne. On pakutud mitmeid võimalikke selgitusi. Kuna insuliinil on palju funktsioone, võib eeldada, et mõnes neist on selektiivne defekt. Insuliinitundlikkus võib olla elundispetsiifiline. Kuid on tõenäolisem, et insuliin ei mõjuta munasarja mitte ainult insuliiniretseptorite, vaid ka insuliinitaoliste kasvufaktorite (IGF) retseptorite kaudu.
Insuliini retseptorid ja IGF-1 retseptorid on tuvastatud inimese munasarjades (tervete naiste, PCOS-i põdevate naiste munasarjade stroomakoes, folliikulite kudedes ja granuloosrakkudes). Insuliin võib seonduda IGF-1 retseptoritega, kuigi madalama afiinsusega kui tema enda retseptorid. GI-ga, aga ka olukorras, kus insuliiniretseptorid on blokeeritud või puudulikud, võib eeldada, et insuliin seondub suuremal määral IGF-1 retseptoritega.
Võimalik, et insuliini / IGF-1 steroidogeneesi stimuleerimise mehhanismid munasarjas võib jagada mittespetsiifilisteks ja spetsiifilisteks. Mittespetsiifilised on insuliini klassikalised toimed glükoosile, aminohapete metabolismile ja DNA sünteesile. Selle tulemusena suureneb raku elujõulisus ja järelikult paraneb hormoonide süntees. Spetsiifilised mehhanismid hõlmavad otsene tegevus insuliin / IGF-1 steroidogeensetele ensüümidele, insuliini ja LH / FSH sünergia ning mõju LH retseptorite arvule.
Insuliin / IGF-1, mis toimib sünergistlikult FSH-ga, stimuleerib aromataasi aktiivsust granuloosrakkude kultuuris ja suurendab seeläbi östradiooli sünteesi. Lisaks põhjustavad need LH-retseptorite kontsentratsiooni suurenemist, suurendades LH-sõltuvat androsteendiooni sünteesi teeka ja stroomarakkude poolt.
Androgeenide suurenev kontsentratsioon munasarjas insuliini / IGF-1 toimel põhjustab follikulaarset atreesiat, mis viib östrogeeni ja progesterooni tootvate granuloosrakkude järkjärgulise eliminatsioonini, millele järgneb tekaalsete rakkude hüperplaasia ja interstitsiaalse koe luteiniseerumine. munasarjad, mis on androgeenide tootmise koht. See seletab asjaolu, et munasarjade steroidogeneesi stimuleerimine insuliiniga avaldub peamiselt hüperandrogenismi kujul.
On oletatud, et insuliin / IGF-1 võib stimuleerida nii tsütokroom P450c17a LH-sõltuvat aktiivsust munasarjades kui ka P450c17a ACTH-sõltuvat aktiivsust neerupealistes. See ilmselt seletab munasarjade ja neerupealiste hüperandrogenismi vormide sagedast kombinatsiooni PCOS-iga patsientidel.
Võimalik on ka suhe S.S.C. Jeen neerupealiste steroidogeneesi osaluse kohta PCOS-i patogeneesis (skeem 2).

Skeem 2. Insuliini toime polütsüstiliste munasarjade sündroomi korral
V. Insler (1993), kes uuris insuliini, IGF-1, kasvuhormooni taset ja nende korrelatsiooni gonadotropiinide ja androgeenide tasemega PCOS-iga naistel, pakkus välja kaks mudelit selle sündroomi tekkeks. Rasvunud patsientidel kutsub GI esile androgeenide ületootmise IGF-1 retseptorite kaudu, mis, toimides sünergias LH-ga, põhjustavad tsütokroom P450c17a, peamise androgeenide sünteesi kontrolliva ensüümi aktiivsuse tõusu. Normaalse kehakaaluga patsientidel stimuleerib kasvuhormooni kontsentratsiooni suhteline tõus IGF-1 liigset tootmist. Sellest hetkest alates põhjustab sünergis LH-ga androgeenide ületootmist sama mehhanismi abil nagu rasvunud patsientidel. Androgeenide taseme tõus põhjustab muutusi hüpotalamuse keskuste funktsioonis, mis põhjustab gonadotropiinide sekretsiooni rikkumist ja PCOS-i tüüpilisi muutusi (skeem 3).
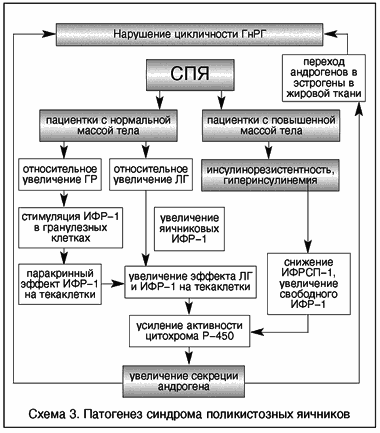
Skeem 3. Polütsüstiliste munasarjade sündroomi patogenees
3. Siiski on mitmeid tuntud IR-haigusi, mis ei ole seotud GA-ga, näiteks lihtne rasvumine ja 2. tüüpi diabeet. Selgitamaks, miks kõigil seedetraktiga rasvunud patsientidel ei teki hüperandrogenismi ja PCOS-i, esitas hüpoteesi geneetilise eelsoodumuse olemasolu kohta insuliini stimuleeriva toime suhtes androgeenide sünteesile munasarjas ... Ilmselt on geen või geenide rühm, mis muudab PCOS-iga naise munasarjad tundlikumaks androgeenide tootmise insuliini stimuleerimise suhtes.Insuliiniresistentsuse tekkeni viivad molekulaarsed mehhanismid ei ole täielikult teada. Hiljutised edusammud molekulaarbioloogias on aga võimaldanud määrata munasarjade hüperandrogenismiga naistel insuliiniretseptorit kodeeriva geeni struktuuri.
Moller ja Flier uurisid aminohappejärjestust DNA ahelate struktuuris munasarjade hüperandrogenismiga patsientidel. Nad leidsid koodonis 1200 serosiini asendamise trüptofaaniga. Teadlased väitsid, et selline muutus häirib türosiinkinaasi süsteemi aktiveerimist insuliiniretseptoris. Insuliiniretseptorite madal aktiivsus põhjustab IR ja kompenseeriva GI arengut.
Yoshimasa jt. kirjeldas teist punktmutatsiooni varianti hüperandrogenismi, insuliiniresistentsuse ja acanthosis nigricansiga patsiendil. Nad leidsid insuliiniretseptori tetrameerses struktuuris arginiini asendamise seriiniga. See mutatsioon aktiivses lookuses muutis a- ja b-subühikute ühendamise võimatuks, mille tulemusena ei sünteesitud funktsionaalselt aktiivset retseptorit. Ülaltoodud uuringud on vaid esimesed katsed tuvastada munasarjade strooma tekomatoosi spetsiifilist geneetilist etioloogiat.
Hiljem märgib Dunaif A., et polütsüstiliste munasarjade sündroomi korral võib IR-i põhjustada insuliiniretseptori (IR) b-subühikute autofosforüülimise häire, mille tsütoplasmaosas on türosiinkinaasi aktiivsus. Samal ajal suureneb seriinijääkide (PCOS-ser) insuliinist sõltumatu fosforüülimine türosiinkinaasi aktiivsuse pärssimisega (sekundaarne signaali edastaja, mis määrab insuliini tundlikkuse samanimeliste retseptorite suhtes). See defekt on iseloomulik ainult PCOS-sõltuvale IR-le, teiste insuliiniresistentsete seisundite (rasvumine, NIDDM) korral neid muutusi ei tuvastata.
Ei saa välistada, et PCOS-ser-is esineb mõni seriini fosforüüliv faktor. Seega eraldatakse näiteks seriin/treoniinfosfataasi inhibiitor, mis ilmselt häirib IR fosforüülimist PCOS-ser-is. See ühend on sarnane hiljuti eraldatud membraani glükoproteiiniga PC-1 (insuliini retseptori türosiinkinaasi inhibiitor), kuid viimane ei suurenda seriini IR insuliinist sõltumatut fosforüülimist.
Kasvajanekroosifaktor-a (TNF-a) on sarnased omadused: seriinijääkide IRS-1 (üks IR-signaali sekundaarsetest saatjatest) fosforüülimine TNF-a mõjul toob kaasa IR-i türosiinkinaasi aktiivsuse pärssimise.
Moller et al. leidis, et inimese seriini P450c17, peamise ensüümi, mis reguleerib neerupealiste ja munasarjade androgeenide biosünteesi, fosforüülimine suurendab 17,20-lüaasi aktiivsust. Steroidogeneesi ensümaatilise aktiivsuse moduleerimist seriini fosforüülimise teel on kirjeldatud 17b-hüdroksüsteroiddehüdrogenaasi puhul. Kui eeldada, et sama faktor (ensüüm) fosforüülib insuliiniretseptori seriini, põhjustades IR-i ja P450c17 seriini, põhjustades hüperandrogenismi, siis on PCOS-i ja IR-i seos seletatav. In vitro katsed on näidanud, et proteiinkinaas A (seriin/treoniini kinaas) katalüüsib insuliiniretseptorite seriini fosforüülimist (skeem 4).

Skeem 4. Insuliiniresistentsuse geen PCOS-is
Leptiini roll PCOS-isViimasel ajal on läbi viidud mitmeid uuringuid bioloogiline roll leptiini, mille tulemused on julgustavad. Valguhormoonina mõjutab leptiin toitumiskäitumist ja avaldab lubavat mõju loomade puberteediea algusele. Kahjuks ei ole selle hormooni roll inimese ainevahetuse ja reproduktiivfunktsiooni reguleerimisel täielikult välja selgitatud. Sel põhjusel on andmed leptiini taseme kohta munasarjade hüperandrogenismi kombinatsioonis insuliiniresistentsusega ja arusaam selle rollist nende muutuste tekkes väga vastuolulised.
Viimasel ajal on leptiini bioloogilise rolli kohta tehtud mitmeid uuringuid, mille tulemused on julgustavad. Valguhormoonina mõjutab leptiin toitumiskäitumist ja avaldab lubavat mõju loomade puberteediea algusele. Kahjuks ei ole selle hormooni roll inimese ainevahetuse ja reproduktiivfunktsiooni reguleerimisel täielikult välja selgitatud. Sel põhjusel on andmed leptiini taseme kohta munasarjade hüperandrogenismi kombinatsioonis insuliiniresistentsusega ja arusaam selle rollist nende muutuste tekkes väga vastuolulised.Seega Brzechffa jt uuringu kohaselt. (1996), on märkimisväärsel osal PCOS-i populatsioonist naiste leptiini tase oodatust kõrgem, arvestades nende KMI-d, vaba testosterooni ja insuliinitundlikkust. Teisest küljest ei ole hiljutised tööd selles valdkonnas näidanud olulisi erinevusi leptiini tasemes PCOS-iga uuringurühmades ja kontrollrühmades. Lisaks leiti, et basaalinsuliini tase, gonadotropiinide ja sugusteroidide sisaldus ei mõjuta leptiini sisaldust. Kuid Zachow ja Magffin (1997), võttes arvesse andmeid leptiini retseptorite mRNA olemasolu kohta munasarjakoes, näitasid selle hormooni otsest mõju roti granuloosrakkude steroidogeneesile in vitro. Samal ajal ilmnes leptiini annusest sõltuv supresseeriv toime IGF-1-le, mida võimendas granuloosrakkude FSH-stimuleeritud E2 sünteesi suurenemine. Need andmed toetavad hüpoteesi, et kõrgenenud leptiini tase rasvunud inimestel võib küpsemist takistada. domineeriv folliikuli ja ovulatsioon. Väga huvitavad on Spiceri ja Franciso (1997) andmed, mis näitavad, et kasvavates kontsentratsioonides (10-300 ng/ml) inhibeerib leptiin insuliinist sõltuvat E2 ja progesterooni tootmist granuloosrakkude kultuuris. See toime on tingitud leptiini spetsiifiliste sidumissaitide olemasolust. Selle analoogia põhjal võib eeldada, et kõrge tase leptiin võib vähendada teiste sihtkudede tundlikkust endogeense insuliini toime suhtes, mis põhjustab rasvumise korral IR arengut.
Diagnoos Munasarjade hüperandrogenismi sündroomi diagnostika tüüpilise kliiniline pilt ei ole raske. Esiteks on see menstruaaltsükli funktsiooni rikkumine oligo-, opso- või amenorröa tüübi järgi, anovulatsioon ja sellest tulenev primaarne või sekundaarne viljatus, hirsutism, akne, 40% patsientidest on erineva raskusastmega rasvumine. Günekoloogiline uuring näitab munasarjade suuruse kahepoolset suurenemist, sageli hüpoplastilise emaka taustal.
Hormonaalsed uurimismeetodid mängivad PCOS-i diagnoosimisel olulist rolli. , mille eesmärk on tuvastada hüperandrogenism, selle allikas ja määrata gonadotroopsete hormoonide tase: LH ja FSH. PCOS-iga patsientidel on LH tase sageli ülekaalus FSH-st, nende suhe on halvenenud ja suurenenud (üle 2,5-3). Prolaktiini tase on normaalne, kuigi 30% patsientidest täheldatakse mõningast tõusu.
Kogu 17-KS uriiniga eritumise tase PCOS-i korral on väga erinev ja ei ole väga informatiivne. 17-KS fraktsioonide (DHA, 11-oksüdeeritud ketosteroidid, androsteroon, etiokolanoloon) määramine ei võimalda samuti tuvastada hüperandrogenismi allika lokaliseerimist. Hüperandrogenismi munasarjade allika kinnitus on androsteendiooni (A) ja testosterooni (T) taseme tõus veres ning A / T suhte suurenemine. Hüperandrogenismi neerupealiste teket kinnitab dehüdroepiandrosterooni (DHA) ja selle sulfaadi (DHA-S) ning 17-hüdroksüprogesterooni (17-OH-R) taseme tõus veres. Hüperandrogenismi allika lokaliseerimise selgitamiseks on välja pakutud erinevad funktsionaalsed testid, millest levinumad on test deksametasooniga, sünakteen-depooga.
Võttes arvesse uute patogeneetiliste seoste avastamist PCOS-i arengus, on süsivesikute metabolismi olukorra hindamiseks vaja läbi viia standardne glükoositaluvuse test (75 ml glükoosi per os) glükoosi ja immunoreaktiivse taseme määramiseks. insuliini (IRI) taset. Insuliiniresistentsuse kasuks viitavad ka KMI üle 25 ja OT/OB üle 0,85, samuti düslipideemia.
Ravi Keskmes kaasaegne lähenemine PCOS-i patogeneetilisele ravile munasarjade funktsiooni kahjustuse taastamise põhimõte
, see tähendab anovulatsiooni kõrvaldamist, mis omakorda viib hüperandrogenismi vähenemiseni ja follikulogeneesi taastumiseni. Munasarjade hüperandrogenismi etiopatogeneesi tunnuste uurimine viib aga järeldusele, et PCOS-i adekvaatse ravi meetodite valik ei ole lihtne ülesanne.
Kombineeritud suukaudsed rasestumisvastased vahendid on PCOS-i jaoks kõige sagedamini kasutatav ravimite rühm. Toimemehhanism on kõrgenenud LH pärssimine, LH / FSH suhte normaliseerimine ja CCH sünteesi suurendamine maksas. Pärast tühistamist saavutatakse "tagasilöögiefekt", mis seisneb hüpotalamuse-hüpofüüsi funktsiooni normaliseerimises, androgeenide ületootmise vähendamises munasarjakoe poolt, follikulogeneesi normaliseerimises ja ovulatsiooni taastamises.
Ravi viiakse läbi vastavalt standardskeemile: 1 tablett päevas 5 kuni 25 tsükli päeva jooksul 3-6 kuud. Vajadusel kursusi korratakse. Siiski on teada, et östrogeeni-progestogeensete rasestumisvastaste vahendite pikaajaline kasutamine võib põhjustada hüperinsulineemiat, raskendades seeläbi PCOS-i peamist patogeneetilist seost.
Mõned rasestumisvastased vahendid sisaldavad progestogeenseid komponente, 19-norsteroidide derivaate (noretisteroon, levonorgestreel), millel on erineva raskusastmega androgeenne toime, ja seetõttu on neid komponente sisaldavate ravimite määramine hirsutismiga patsientidele piiratud. Hüperandrogenismi sümptomite korral on soovitatav kasutada suukaudseid rasestumisvastaseid vahendeid koos gestageeniga, millel puudub androgeenne toime.
Võib-olla kasutatakse gestageenseid ravimeid, millel puuduvad androgeensed omadused, monoteraapiana, eriti endomeetriumi hüperplaasia korral. Düdrogesterooni on ette nähtud 1 tablett (10 mg) 2 korda päevas 14-16 kuni 25 päeva jooksul tsükli jooksul, mis kestab 3 kuni 6 kursust.
Kõige tõhusam viis ovulatsiooni stimuleerimiseks PCOS-i korral on antiöstrogeeni ravim klomifeentsitraat ... Antiöstrogeenide peamised toimed on hüpofüüsi ülitundlikkuse vähenemine GnRH toime suhtes, LH tootmise vähenemine, ovulatoorse LH vabanemise esilekutsumine ja ovulatsiooni stimulatsioon. Ravim on ette nähtud 50 mg, 100 mg päevas 5-9 päeva tsüklist kuni ovulatsiooni saavutamiseni vastavalt funktsionaalse diagnostika testidele, kuid mitte rohkem kui 3 kuuri järjest. Hiljuti on avaldatud publikatsioone klomifeentsitraadi mõju kohta insuliini-insuliinitaolise kasvufaktori süsteemile. Nad näitasid, et ovulatsiooni klomifeeniga (150 mg / päevas) stimuleerimise 5. päevaks määrati IGF-1 taseme järkjärguline langus (maksimaalselt 30%). Paljudes teistes sarnastes uuringutes ei leitud aga olulist basaalinsuliini taseme langust vastusena klomifeeni kasutuselevõtule.
Antiandrogeensete omadustega ravimite tulek on oluliselt laiendanud PCOS-i ravivõimalusi. Kõige laialdasemalt kasutatav ravim on Diane-35, mis sisaldab 35 mg etünüülöstradiooli ja 2 mg tsüproteroonatsetaati. Lisaks suukaudsetele rasestumisvastastele vahenditele iseloomulikule toimele blokeerib ravim androgeenide toime sihtrakkude, eriti juuksefolliikulite tasemel. Viimane viib hirsutismi vähenemiseni. Ravimit kasutatakse vastavalt standardskeemile suukaudse rasestumisvastase vahendina kuue või enama tsükliga. Siiski tuleb märkida nende ravimite negatiivset mõju lipiidide ja süsivesikute metabolismile, mis väljendub kolesterooli ja madala tihedusega lipoproteiinide taseme tõusus, samuti hüperinsulineemia suurenemises, mis nõuab nende pidevat dünaamilist jälgimist. parameetrid PCOS-iga patsientidel. Androgeenist sõltuvate dermopaatiate ravis laialdaselt kasutataval spironolaktoonil on ka antiandrogeensed omadused.
Üks peamisi suundi sisse kaasaegne teraapia munasarjade hüperandrogenism on insuliiniresistentsuse ja kompenseeriva hüperinsulineemia kõrvaldamiseks mõeldud ravimite ja vahendite otsimine ja kasutamine.
Esiteks on need meetmed, mis tagavad liigse kehakaalu languse: madala kalorsusega dieet (vahemikus 1500-2200 kcal / päevas) koos rasvade ja kergesti seeditavate süsivesikute piiramisega, piirates soola tarbimist 3-5 g-ni. päevas, mõõdukas kehaline aktiivsus, töörežiimi normaliseerimine ja puhkus. Võib kasutada ravimeid, mis aitavad vähendada KMI-d, näiteks orlistati, mis pärsib selektiivselt seedetrakti lipaase (“rasvablokaator”), või sibutramiini, mis blokeerib norepinefriini ja serotoniini tagasihaarde hüpotalamuse küllastuskeskuse sünapsis. Suurenenud energiakulu (termogenees) on tingitud ka sünergilisest koostoimest norepinefriini ja serotoniini suurenenud funktsiooni vahel kesknärvisüsteemis. See kajastub tsentraalse valikulises aktiveerimises sümpaatne mõju pruunil rasvkoel b 3 -adrenergiliste retseptorite kaudse aktiveerimise tõttu.
Järgmine samm on ravimite kasutamine, mis parandavad kudede tundlikkust insuliini toime suhtes. Kirjanduses on tõendeid hüperandrogenismi vähenemise ning menstruaal- ja ovulatsioonifunktsiooni taastumise kohta mitmete biguaniidide (Metformin / Siofor® /, Berlin-Chemi) väljakirjutamisel. Need võimendavad insuliini toimet retseptori ja retseptori järgsel tasemel ning parandavad oluliselt kudede tundlikkust selle hormooni suhtes. Mõned uuringud on näidanud tühja kõhuga insuliinitaseme olulist langust ja 2 tundi pärast 75-grammise glükoosi manustamist PCOS-iga naistel, kes kasutasid metformiini. See langus oli korrelatsioonis androgeenide taseme langusega. Samuti tuleb märkida, et süsivesikute häireid normaliseerivate biguaniidide kasutamine põhjustab rasvunud patsientidel sageli KMI langust ja avaldab positiivset mõju lipiidide metabolismile.
Maailmakirjandus avaldab tiasolidiindioonide klassi kuuluvate ravimite kasutamise tulemusi. Uuringud on näidanud, et ravi ajal troglitasoon (200-400 mg / päevas) parandab PCOS-iga naiste insuliinitundlikkust ja vähendab androgeenide taset. Selle ravimite rühma paljastatud tsütotoksiline hepatotoksiline toime piirab aga nende laialdase kasutamise võimalust. Käimas on uute ravimite otsimine, mis selektiivselt insuliinitundlikkust mõjutavad.
Vaatamata munasarjade hüperandrogenismi raviks kasutatavate erinevate ainete märkimisväärsele arsenalile, peaks selle patoloogia ravi olema terviklik ja järjekindel, võttes arvesse juhtivat patogeneetilist seost selles ravietapis.
PCOS-iga naiste ravi peaks olema suunatud mitte ainult selle haiguse tuvastatud sümptomite korrigeerimisele, vaid ka võimalike tulevaste tüsistuste ärahoidmisele. Väga oluline on androgeenide liigse sekretsiooni mahasurumine ja igakuise menstruaalverejooksu stabiilsuse esilekutsumine, mis saavutatakse õnnelikult antiandrogeensete omadustega ravimite (Diane-35) kasutamisega.
Ebaefektiivsuse korral konservatiivne ravi aasta pärast võite esitada küsimuse kirurgiline ravi - laparoskoopia munasarjade kiiluresektsiooniga või nende laseraurustamine ... Tõhusus kirurgiline ravi kõrge (kuni 90-95% ovulatsiooni taastumisest) ja esialgne patogeneetiline ravi suurendab saavutatud tulemuse stabiilsust.
Kirjandus:1. Ovsjannikova T.V., Demidova I.Yu., Glazkova O.I. Paljunemisprobleemid, 1998; 6: 5-8.
2. Ginzburg M.M., Kozupitsa G.S. Endokrinoloogia probleemid, 1997; 6: 40-2.
3. Starkova N.T. Kliiniline endokrinoloogia. Juhend arstidele, 1991; 399.
4. Arvestades J. R., Wiedeme E. B-endorfiini ja B-lipotropiini taset hirsute naiste puhul: korrelatsioon kehakaaluga. J Clin Endokri metabolism. 1980; 50: 975-81.
5. Aleem F.A., McIntosh T. F-endorfi kõrgenenud plasmatase polütsüstiliste munasarjade haigusega naiste rühmas. Viljakas ja steriilne. 1984; 42: 686-9.
6. Dedov I.I., Suntsov Yu.I., Kudrjakova S.V. Endokrinoloogilised probleemid. 1998; 6: 45-8.
7. Francis S., Greenspan, Forshman P.H. Põhiline ja kliiniline endokrinoloogia. 1987.
8. Akmaev I.K. Endokrinoloogilised probleemid. 1990; 12-8.
9. Barbieri R.L., Hornstein M.D. Hüperinsulineemia ja munasarjade hüperandrogenism: põhjus ja tagajärg. Endocrinol Metab Clin North Am. 1988; 17: 685-97.
10. Barbieri R.L., Macris A., Ryan K.J. Insuliin stimuleerib androgeenide akumuleerumist inimese munasarja strooma ja teeka inkubeerimisel. Obstet Gynecol. 1984; 64: 73-80.
11. Barbieri R.L., Ryan K.J. Hüperandrogenism, insuliiniresistentsus, acantosis nigricans: tavaline endokrinopaatia, millel on ainulaadsed patofüsioloogilised tunnused. Olen J Obstet Gynecol. 1983; 147: 90-103.
12. Barbieri R.L., Smith S., Ryan K.J. Hüperinsulinemia roll munasarjade hüperandrogenismi patogeneesis. Viljakas ja steriilne. 1988; 50: 197-210.
13. Stuart C.A., prints M.J., Peters E.J. Obstet Gynecol. 1987; 69: 921-3.
14. Yen S.S.C. Perifeersete endokriinsete häirete põhjustatud krooniline anovulatsioon. In: Yen S.S.C., Jaffe R.B. Reproduktiiv-endokrinoloogia: füsioloogia, patofüsioloogia ja kliiniline juhtimine. Philadelphia: Saunders W.B. 1986; 462-87.
15. Moller D.E., Flier J.S. Insuliiniretseptori geeni muutuse tuvastamine insuliiniresistentsuse, acantosis nigricansi ja polütsüstiliste munasarjade sündroomiga patsiendil. N Engl J Med. 1988; 319: 1526-32.
16. Burgen G.A., Givens J.R. Insuliiniresistentsus ja hüperandrogenism: kliinilised sündroomid ja võimalikud mehhanismid. Hemisphera Publishing CO, Washington, DC. 1988; 293-317.
17. Speroff L., Glass R. H. Kliiniline günekoloogiline. Endokrinoloogia ja viljatus, 5. väljaanne. 1994. aasta.
18. Yoshimasa Y., Seino S. jt. Insuliiniresistentsuse diabeet punktmutatsiooni tõttu, mis takistab insuliini proretseptorite töötlemist./ Teadus. 1988; 240: 784-9.
19. Dunaif A. Endokriin. Rev. 18 (6): 1997; 12: 774-800.
Etünüülöstradiool + tsüproteroonatsetaat
Diane-35 (kaubanimi)
(Shering AG)
Hüperandrogenism on endokriinne haigus, mis on põhjustatud meessuguhormoonide suurenenud sekretsioonist naise kehas. Androgeene toodavad munasarjad ja neerupealiste koor. Sõltuvalt sellest, esmane põhjus Patoloogiad võivad erineda kliinilised sümptomid.
Hüperandrogenism põhjustab naistel suurenenud luteiniseeriva hormooni sekretsiooni hüpofüüsis, mis blokeerib folliikuleid stimuleeriva hormooni ja östradiooli vabanemise. Selle tulemusena on folliikulite küpsemise protsess häiritud, munaraku vabanemist ei toimu (anovulatsioon). Kõrge androgeenitase aitab kaasa mitmete tsüstide tekkele munasarjades (polütsüstiliste munasarjade sündroom).
Meessuguhormoonid vähendavad perifeersete kudede vastuvõtlikkust insuliinile, mis põhjustab vere glükoosisisalduse tõusu, glükoositaluvuse halvenemist, süsivesikute ainevahetust ja II tüüpi suhkurtõve teket.
Klassifitseerige tõeline ja idiopaatiline hüperandrogenism. Esimesel juhul tõstetakse androgeenide taset naise veres, teisel aga perifeerse koe retseptorite tundlikkust meessuguhormoonide suhtes.
Patoloogia põhjused
Mis on hüperandrogenism ja miks see tekib? Haiguse peamised põhjused on:
- kasvajad, metastaasid neerupealistes;
- hüpotalamuse-hüpofüüsi regulatsiooni rikkumine, mis on põhjustatud traumast, kasvajatest, aju põletikulistest haigustest;
- munasarja kasvajad: luteoom, tekoma;
- androgenitaalne sündroom on neerupealiste koore kaasasündinud kõrvalekalle, mille korral suureneb testosterooni tootmine.

Naistel põhjustavad hüperandrogenismi põhjused hormonaalse tasakaalu, reproduktiivsüsteemi toimimise, keha ainevahetusprotsesside rikkumist.
Munasarjade hüperandrogenismi sümptomid
Haigus on munasarjade ja neerupealiste tekkega – olenevalt organist, mis hakkab intensiivselt androgeene tootma. Munasarjade hüperandrogenism areneb enamikul juhtudel polütsüstiliste munasarjade sündroomi taustal, harvemini põhjustavad patoloogiat hormoone tootvad kasvajad.
PCOS-i iseloomustab häire menstruaaltsükli, viljatus, androgeenide taseme tõus veres. Tüdruku figuur muutub vastavalt mehelikule tüübile, karvad näol ja kehal hakkavad kasvama, talje ja rindkere maht suureneb, rasvakiht ladestub alakõhus. Rasunäärmete töö on häiritud, ilmneb seborröa, akne, mis ei allu ravile. Reite, tuharate nahale tekivad venitusarmid. Uneapnoe(hinge kinnihoidmine) viib unetuseni.
Fotol naine, kellel iseloomulikud tunnused hirsutism.

PCOS-i hüperandrogenismi iseloomulikud sümptomid on premenstruaalse sündroomi ilmnemine. Naised muutuvad ärrituvaks, tuju muutub sageli, migreenimured, intensiivsed valud alakõhus, tursed, piimanäärmete valulikkus.
Munasarjad suurenevad 2-3 korda, nende kapsel pakseneb. Oreli sees mitmekordne tsüstilised moodustised... Hormonaalne tasakaalutus põhjustab emaka endomeetriumi paksenemist ja hüperplaasiat, menstruatsioon muutub pikemaks, rikkalikumaks, verehüüvete vabanemisega.
Neerupealiste hüperandrogenismi sümptomid
Seda tüüpi virilisatsioon areneb androgenitaalse sündroomi taustal. See on pärilik haigus, mis põhjustab androgeenide suurenenud sekretsiooni neerupealise koores. Elundite ensüümide kaasasündinud puudulikkuse teatud punktini kompenseerib organism, kuid mitmete tegurite mõjul tekib hormonaalne tasakaalutus. Rasedus võib sellist seisundit esile kutsuda, tugev stress, seksuaalse tegevuse algus.

Neerupealiste hüperandrogenismi põhjuseks võivad olla hormoone tootvad kasvajad, Itsenko-Cushingi tõbi, hüperprolaktineemia, akromegaalia. Vähirakud retikulaarses ajukoores toodavad "nõrku" androgeene. Ainevahetuse käigus muutuvad meessuguhormoonid aktiivsemaks ja muudavad naise üldist hormonaalset tausta. Rasvumine aitab neid protsesse kiirendada.
Neerupealiste hüperandrogeensus põhjustab östrogeeni taseme tõusu tõttu tsüklilisi häireid munasarjades, pärsitakse folliikuli kasv ja küpsemine, menstruaaltsükkel on häiritud, menstruatsioon võib sootuks katkeda. Ovulatsiooniprotsess ei toimu, naine ei saa rasestuda ega sünnitada.

Neerupealiste hüperandrogenismi sümptomid tüdrukutel:
- välissuguelundite deformatsioon sündides, lapse sugu on raske määrata (naiste hermafroditism);
- seksuaalse arengu hilinemine, menarhe algab 15-16-aastaselt, menstruaaltsükkel on ebaregulaarne, millega kaasneb suur verekaotus;
- noorukitel tüdrukutel täheldatakse hirsutismi tunnuseid: näol ja kehal kasvavad karvad nagu meestel;
- akne, seborröa, naha pigmentatsioon;
- piimanäärmete osaline atroofia;
- kliitori suuruse suurenemine;
- alopeetsia - juuste väljalangemine peas;
- figuur muutub: kitsad puusad, laiad õlad, lühike kasv;
- kare hääl.

Reproduktiivses eas naistel põhjustab neerupealiste hüperandrogenism raseduse varajase katkemise. Selle põhjuseks on emaka kasvu peatumine defektse kollakeha moodustumise tõttu. Enamikul tüdrukutel on menstruaal- ja sünnitusfunktsioon täielikult häiritud, tekib viljatus, suureneb seksuaalne soov. Hirsutism on halvasti väljendunud, kehaehitus ei muutu, ainevahetusprotsesse ei häirita.
Segatüüpi hüperandrogenism
Segageneesi hüperandrogenism avaldub haiguse munasarjade ja neerupealiste vormide sümptomites. Naistel on polütsüstiliste munasarjade haigus ja androgenitaalsündroomi nähud.
Segatüüpi haiguse ilmingud:
- vinnid;
- striae;
- suurenenud vererõhk;
- menstruaaltsükli rikkumine, amenorröa;
- tsüstid munasarjades;
- viljatus, raseduse varajane katkestamine;
- glükoositaluvuse häire või kõrge veresuhkur;
- madala tihedusega lipoproteiinide suurenenud sisaldus.

Hüperandrogenismi võivad põhjustada süsteemsed haigused, mis mõjutavad neerupealiste koort, munasarju või aju ning häirivad ainevahetust. Need on hüpofüüsi adenoomid, anorexia nervosa, skisofreenia, diabeet 2 tüüpi, akromegaalia, prolaktinoom.
Perifeerne ja tsentraalne hüperandroegnia
Keskse lüüasaamisega närvisüsteem, põletikulised, nakkushaigused või keha mürgistus, võib pärssida luteiniseerivate ja folliikuleid stimuleerivate hormoonide tootmise eest vastutavate hüpofüüsi gonadotroopsete hormoonide sekretsiooni. Selle tulemusena on häiritud folliikuli küpsemisprotsess munasarjas ja suguhormoonide süntees ning suureneb androgeenide tootmine.
Naistel leitakse polütsüstilise haiguse sümptomeid, munasarjade düsfunktsiooni, menstruaaltsükli häireid, nahalööbeid, PMS-i.

Perifeerset hüperandrogenismi põhjustab nahaensüümi, rasunäärmete 5-α-reduktaasi aktiivsuse tõus, mis muudab testosterooni aktiivsemaks androgeenseks dihüdrotestosterooniks. See põhjustab erineva raskusastmega hirsutismi, vulgaarse akne ilmnemist.
Hüperandrogenism raseduse ajal
Rasedatel naistel on androgeenide taseme tõus spontaanse abordi põhjuseks. Kõige ohtlikumad perioodid on esimesed 7-8 ja 28-30 nädalat. 40% patsientidest täheldatakse loote emakasisest hüpoksiat, kõige sagedamini kolmandal trimestril. Teine tüsistus on hiline toksikoos, samal ajal kui neerufunktsioon halveneb, vererõhk tõuseb ja keha tursed ilmnevad.
Hüperandrogenism raseduse ajal võib põhjustada lootevee enneaegset väljutamist, komplitseeritud sünnitust. Muutused hormonaalses taustas mõjutavad negatiivselt lapse arengut, imikute ajuvereringe võib olla häiritud, esineb emakasisese alatoitluse tunnuseid.

Hüperandrogenism ja rasedus on põhjused kiireloomuliseks hormoonraviks, et vältida aborti ja muid tüsistusi. Naised, kellel on varem olnud raseduse katkemine, raseduse katkemine, meessuguhormoonide taseme tõus, tuleb raseduse planeerimise etapis läbi viia põhjalik uuring.
Haiguse diagnoosimine
Diagnoos - hüperandrogenism tuvastatakse hormoonide taseme laboratoorsete analüüside tulemuste põhjal. Polütsüstiliste munasarjade sündroomiga naise veres tõuseb testosterooni, androsteendiooni ja luteiniseeriva hormooni tase. FSH, prolaktiini, DHEA kontsentratsioon veres ja 17-CS kontsentratsioon uriinis jääb normi piiridesse. LH / FSH suhe suurenes 3-4 korda. Hormoonsõltuvate munasarjakasvajate korral suureneb testosterooni ja prolaktiini tase veres oluliselt.

Haiguse segavormi iseloomustab testosterooni, LH, DHEA-S taseme kerge tõus veres ja 17-KS taseme tõus uriinis. Prolaktiini kontsentratsioon on normaalne ning östradiool ja FSH on vähenenud. LH/FSH suhe on 3,2.
Hüperandrogenismi esmase põhjuse väljaselgitamiseks tehakse testid deksametasooni ja kooriongonadotropiiniga. HCG testi positiivne tulemus kinnitab polütsüstiliste munasarjade haigust, mis põhjustab hormonaalset tasakaalutust. Eitav vastus näitab hüperandrogenismi neerupealiste olemust.

Abrahami test paljastab neerupealiste tekkehaiguse, sünteetiliste glükokortikoidide kasutuselevõtuga pärsitakse ACTH süntees hüpofüüsi eesmises osas, mis peatab neerupealiste koore stimulatsiooni. Kui tulemus on positiivne, on tegemist neerupealiste hüperandrogenismiga, negatiivne vastus võib olla märk kortikaalsest kasvajast.
Lisaks tehakse munasarjade ultraheliuuring, et tuvastada tsüstid, muutused elundi suuruses ja struktuuris. Hüpofüüsi kahtluse korral on näidustatud elektroentsefalograafia, MRI, aju CT.
Ravi meetodid
Ravi määratakse igale patsiendile individuaalselt. Androgeeniretseptorite blokaatorid vähendavad meessuguhormoonide toimet nahale, munasarjadele (Flutamiid, Spironolaktoon). Androgeeni sekretsiooni inhibiitorid pärsivad testosterooni tootmist endokriinsete näärmete poolt (tsüproteroonatsetaat). Need vahendid taastavad hormoonide tasakaalu, kõrvaldavad patoloogia sümptomid.
Neerupealiste hüperandrogenismi kompenseerivad glükokortikoidid, mis suruvad alla androgeenide liigset kogust. Naistele määratakse deksametasoon, prednisoloon ja neid võetakse raseduse ajal, kui tulevasel emal on suurenenud testosterooni tase. Eriti oluline on õigeaegselt ravida tüdrukuid, kellel on kaasasündinud androgeense sündroomiga lähisugulased. Ravimi annuse ja kestuse määrab arst.

Hüperandrogenismi hormonaalne ravi viiakse läbi kombineeritud glükokortikosteroididega suukaudsed rasestumisvastased vahendid(Diane-35), GnRH agonistid. Selliste ravimitega ravitakse kerget hüperandrogenismi. munasarjade teke, PCOS.
Ravimivaba ravi
Hormonaalse tasakaalu taastamiseks soovitatakse naistel regulaarselt mõõdukalt treenida kehaline aktiivsus, loobuma halbadest harjumustest, juhtima tervislik pilt elu. Oluline on kinni pidada dieedist, teha tasakaalustatud toitumine, mis välistab kohvi, alkoholi, süsivesikuid, loomseid rasvu. Kasulik on süüa värskeid puuvilju, köögivilju, Piimatooted, dieetliha ja kala. Vitamiinide puuduse täiendamiseks võetakse ravimpreparaate.

Ravi rahvapärased abinõud saab läbi viia ainult koos põhiteraapiaga. Kõigepealt peaksite konsulteerima arstiga.
Hüperandrogenism põhjustab häireid paljude elundite ja süsteemide töös, viib neerupealiste ja munasarjade puudulikkuse, viljatuse, II tüüpi suhkurtõve tekkeni. Hirsutismi, nahalööbe, metaboolse sündroomi sümptomite ilmnemise vältimiseks on näidustatud hormoonravi.
Bibliograafia
- Kozlova V.I., Puchner A.F. Suguelundite viirus-, klamüüdia- ja mükoplasmahaigused. Juhend arstidele. Peterburi 2000.-574 lk.
- Raseduse katkemine, infektsioon, kaasasündinud immuunsus; Makarov O.V., Bakhareva I.V. (Gankovskaja L.V., Gankovskaja O.A., Kovaltšuk L.V.) - "GEOTAR - meedia." - Moskva. - 73 lk - 2007.
- Hädaolukorrad sünnitusabis ja günekoloogias: diagnoosimine ja ravi. Pearlman M., Tintinally J. 2008 Kirjastaja: Binom. Teadmiste labor.
- L. V. Adamyan ja muud emaka ja tupe väärarengud. - M .: Meditsiin, 1998.
Segageneesi hüperandrogenism võib ilmneda haiguse munasarjade ja neerupealiste vormide tunnustega. Iga reproduktiivses eas naise jaoks on üks ebameeldivamaid haigusi. Seda haigust esineb 4-6% fertiilses eas naistest. Selle probleemi peamiste põhjuste hulgas tuleks märkida meessuguhormoonide liigset taset ja intensiivset füüsilist aktiivsust.
Munasarjade hüperandrogenismi sümptomid
Selle haiguse peamised sümptomid on kosmeetilised ilmingud - akne, juuste väljalangemine ja hirsutism. Lisaks võib hüperandrogenismil olla ka günekoloogilisi ilminguid. Väga sageli on selle haiguse all kannatavatel naistel menstruaaltsükli häired ja polütsüstiliste munasarjade sündroom. Teine ebameeldiv günekoloogiline sümptom on viljatus. Samuti väärib märkimist, et rasvumine, suhkurtõbi, düslipideemia ja meessuguhormoonide ilmingud võivad olla selle haiguse sümptomid. Need märgid hõlmavad järgmist:
- näo juuste kasv;
- hääle tämbri muutmine;
- õlgade pikendamine.
Diagnostika
Diagnoosida saab isegi kerget munasarjade hüperandrogenismi. Seetõttu peaksid naised, kes seisavad silmitsi ülaltoodud sümptomitega, kindlasti pöörduma spetsialiseeritud spetsialistide poole. Selle haiguse diagnoosimine põhineb tavaliselt ultraheli, hormonaalsete ja kliiniliste uuringute andmetel. Munasarjade hüperandrogenismi all kannatavatel patsientidel on reeglina suurenenud kehamassiindeks ja hirsute arv 15,2 ± 0,6. Samuti diagnostilise läbivaatuse käigus olemasolu kõrge kontsentratsioon testosteroon, luteiniseerivad ja folliikuleid stimuleerivad hormoonid. Ultrahelis võib ilmneda munasarjade mahu suurenemine ja strooma hüperplaasia.
Patoloogia ravi
Munasarjade hüperandrogenismi ravi peaks määrama eranditult spetsialiseerunud spetsialist. Ravi meetod sõltub otseselt patsiendi eesmärkidest. Kui ta kavatseb tulevikus lapsi rasestuda, kasutatakse raviks kõige sagedamini klomifeeni. Juhul, kui patsient ei kavatse viljakust taastada, määrab raviarst tõenäoliselt suukaudse rasestumisvastase ravi. Tänu sellele väheneb oluliselt patsiendi testosterooni ja androsteendiooni tase. Selle ravi alternatiiviks on spironolaktooni võtmine. Samuti saab selle patoloogia raviks kasutada kirurgilist meetodit - munasarjade kirurgilist eemaldamist.
Kerge munasarjade hüperandrogenism, PCOS reageerib hormonaalsele ravile glükokortikosteroidide, kombineeritud suukaudsete kontratseptiivide, GnRH agonistidega.
Mis on neerupealiste hüperandrogenism
Neerupealiste geneesi virilisatsioon avaldub adrenogenitaalse sündroomi (AGS) tekkes - neerupealiste koore kaasasündinud düsfunktsiooni tagajärjel. See on geneetiliselt määratud haigus, mis pärineb autosoomselt retsessiivselt. AGS on seletatav näärme ensüümsüsteemide alaväärsusega: 80-90% patsientidest väljendub alaväärsus C21-hüdroksülaasi puudulikkuses.
Patogenees (mis juhtub?) Neerupealiste hüperandrogenismi ajal
AGS-i peamine patogeneetiline mehhanism on ensüümi C21-hüdroksülaasi kaasasündinud puudulikkus, mis osaleb androgeenide sünteesis neerupealise koores. C21 hüdroksülaasi moodustumise tagab geen, mis asub ühe 6. kromosoomipaari lühikeses käes. Patoloogia ei pruugi avalduda, kui üks patoloogiline geen on päritud ja avaldub defektsete geenide olemasolul mõlemas 6. paari autosoomides. Steroidide sünteesi osaline blokeerimine kaasasündinud C21-hüdroksülaasi puudulikkuse korral suurendab androgeenide sünteesi.
Kuni teatud vanuseni kompenseeritakse kerge C21-hüdroksülaasi puudulikkus neerupealistes. Neerupealiste funktsiooni suurenemisega (emotsionaalne stress, seksuaalse aktiivsuse algus, rasedus) on steroidide süntees häiritud hüperandrogenismi suunas, mis omakorda pärsib gonadotropiinide vabanemist ja häirib tsüklilisi muutusi munasarjades.
Sel juhul on munasarjades võimalik:
- folliikulite kasvu ja küpsemise pärssimine varajased staadiumid follikulogenees, mis põhjustab amenorröa;
- folliikuli ja munaraku kasvu, küpsemise pärssimine, mis ei ole võimeline ovuleerima, mis väljendub anovulatsioonis ja oligomenorröas;
- ovulatsioon defektse kollaskehaga: vaatamata regulaarsele menstruatsioonile esineb tsükli luteaalfaasi puudulikkus.
Kõigi nende munasarjade hüpofunktsiooni variantide korral tekib viljatus. AHS-iga katkemiste sagedus ulatub 26% -ni.
Neerupealiste hüperandrogenismi sümptomid
Sõltuvalt C21-hüdroksülaasi puudulikkuse ja vastavalt hüperandrogenismi tõsidusest eristatakse AHS-i klassikalist vormi ja kopse või hiliseid (puberteedijärgseid ja puberteedijärgseid) AHS-i vorme.
AGS-i klassikalise vormiga kaasneb kaasasündinud neerupealiste hüperplaasia. Selline viriliseerumine toob kaasa väliste suguelundite patoloogia (naise vale hermafroditism) ja ebaõige soo määramise sünnil. Sellise patoloogiaga lapsed läbivad iola kirurgilise korrigeerimise, edasist ravi ja jälgimist teostab laste endokrinoloog.
Puberteedieas on patsientide peamised kaebused hirsutism, akne, ebaregulaarne menstruatsioon. Menarhe algab 15-16 aastaselt, siis on menstruatsioon ebaregulaarne, on kalduvus oligomenorröale. Sel perioodil on hirsutism rohkem väljendunud: karvakasv piki kõhu valget joont, ülahuulel, reie sisekülgedel. Nahk on rasune, poorne, mitme aknega, ulatuslike hüperpigmentatsioonilaikudega. Füüsis on märgata ka androgeenide mõju: kerged mehelikud näojooned laiade õlgade ja kitsa vaagnaga, jäsemete lühenemine, lühike kasv. Pärast hirsutismi tekkimist on piimanäärmed hüpoplastilised.
Jostpubertaalse AHS-iga patsientidel on menstruaal- ja reproduktiivfunktsioon häiritud. AHS-i puberteedijärgne vorm väljendub raseduse varajase katkemisena. Reproduktiivhäirete raskusaste sõltub C21-hüdroksülaasi puudulikkuse astmest: alates anovulatoorsetest tsüklitest tingitud reproduktiivfunktsiooni langusest kuni defektse kollaskeha moodustumisest tingitud raseduse katkemiseni. Hirsutism väljendub kergelt: kõhu valge joone vähene karvakasv, üksikud karvad ülahuule kohal. Kehaehitus on naissoost, piimanäärmed üsna arenenud, ainevahetushäired ebatüüpilised.
Neerupealiste hüperandrogenismi diagnostika
Küsitlemisel tuvastatakse menstruaaltsükli häired patsiendi ema- ja isapoolsetel õdedel ja sugulastel. AGS-iga tekib liigne seksuaalne karvakasv varakult ja kiiresti, menarhe tekib hilja ja menstruatsioon on tulevikus ebaregulaarne.
AGS-i puhul on sportlik kehaehitus, hüpertrichoos, akne, piimanäärmete mõõdukas hüpoplaasia patognoomilised. Erinevalt teistest hüpertrichoosiga kaasnevatest endokriinsetest häiretest ei kaasne AGS-iga kehakaalu suurenemist.
Peamine roll AHS-i diagnoosimisel kuulub hormonaalsetele uuringutele. Androgeenide päritolu selgitamiseks tehakse enne ja pärast deksametasooni testi hormonaalseid uuringuid. 17-KC taseme langus uriinis, testosterooni ja dehüdroepiandrosterooni taseme langus veres pärast ACTH vabanemist pärssivate ravimite võtmist viitab androgeenide neerupealise päritolule.
Postpubertaalse hüpertensiooni diagnoos põhineb:
- hüpertrichoos ja reproduktiivfunktsiooni langus patsiendi ema- ja isapoolsetel õdedel;
- hiline menarhe (14-16-aastased);
- hüpertrichoos ja ebaregulaarne menstruatsioon alates menarhe perioodist;
- morfotüübi viril tunnused;
- 17-KC sisalduse suurenemine uriinis, testosterooni ja dehüdroepiandrosterooni sisalduse suurenemine veres ning nende taseme langus normaalseks pärast deksametasooni võtmist.
Munasarjade ultraheliuuringu andmed viitavad anovulatsioonile: erineva küpsusastmega folliikulid ei saavuta ovulatsioonieelset suurust. Basaaltemperatuur koos venitatud esimese ja lühendatud teise faasiga näitab kollaskeha puudulikkust, tupe määrimise tüüp on androgeenne.
Neerupealiste hüperandrogenismi ravi
Valik ravimid AHS-iga patsientidel määratakse teraapia eesmärk: menstruaaltsükli normaliseerimine, ovulatsiooni stimuleerimine, hüpertrichoosi pärssimine.
Neerupealiste koore hormonaalse funktsiooni häirete korrigeerimiseks kasutatakse glükokortikosteroide. Deksametasooni annus määratakse vastavalt 17-KC sisaldusele uriinis, dehüdroepiandrosteroonile ja testosteroonile veres (ravi ajal ei tohiks nende hormoonide tase ületada normi ülemist piiri). Ravi efektiivsust jälgitakse lisaks hormonaalsetele uuringutele basaaltemperatuuri mõõtmise ja menstruaaltsükli jälgimise teel. Menstruaaltsükli mittetäieliku teise faasi korral on vaja stimuleerida ovulatsiooni 5. kuni 9. päevani, mille taustal tekib sageli rasedus. Spontaanse raseduse katkemise vältimiseks tuleb glükokortikosteroidravi jätkata, selle kestus määratakse individuaalselt.
Kui naine ei ole huvitatud rasedusest ja peamiseks kaebuseks on hüpertrichoos ja pustuloossed nahalööbed, soovitatakse östrogeene ja antiandrogeene sisaldavaid preparaate. Diana mõjutab tõhusalt hüpertrichoosi, eriti kombinatsioonis androkuriga esimese 10-12 päeva jooksul. Diana on ette nähtud menstruaaltsükli 5. kuni 25. päevani 4-6 kuuks.
Antiandrogeense toime annab verospiroon, mis pärsib dihüdrotestosterooni moodustumist testosteroonist nahas, juuksefolliikulisid ja rasunäärmed... Veroshpiron on ette nähtud 25 mg 2 korda päevas. Veroshpironi kasutamine 4-6 kuud vähendab testosterooni taset 80%, kuid kortikotroopsete ja gonadotroopsete hormoonide tase ei langenud.
Sünteetiliste progestiinide kasutamine vähendab ka hüpertrichoosi, kuid nende ravimite kasutamine AHS-iga naistel ei tohiks olla pikaajaline, kuna gonadotropiinide pärssimine on ebasoovitav munasarjade pärsitud funktsiooni korral.
Milliste arstide poole peaksite pöörduma, kui teil on neerupealiste hüperandrogenism?
Günekoloog
Kampaaniad ja eripakkumised
Meditsiiniuudised
12., 13. ja 14. oktoobril toimub Venemaal mastaapne tasuta verehüübimistestide seltskondlik aktsioon “INR Day”. Toiming on ajastatud Maailmapäev võidelda tromboosiga.
07.05.2019
Meningokokkinfektsiooni haigestumus Venemaa Föderatsioonis kasvas 2018. aastal (võrreldes 2017. aastaga) 10% (1). Üks levinumaid viise nakkushaiguste ennetamiseks on vaktsineerimine. Kaasaegsete konjugaatvaktsiinide eesmärk on ennetada meningokokknakkuse ja meningokokk-meningiidi esinemist lastel (isegi varajane iga), noorukid ja täiskasvanud.
25.04.2019
Tulemas on pikk nädalavahetus ja paljud venelased lähevad linnast välja puhkama. Ei ole üleliigne teada, kuidas end puugihammustuste eest kaitsta. Temperatuuri režiim mais soodustab ohtlike putukate aktiveerumist ...
Viirused mitte ainult ei hõlju õhus, vaid võivad sattuda ka käsipuudele, istmetele ja muudele pindadele, jäädes samas aktiivseks. Seetõttu on reisidel või avalikes kohtades soovitatav mitte ainult välistada suhtlemist ümbritsevate inimestega, vaid ka vältida ...
Taastage hea nägemine ja jätke prillidega igaveseks hüvasti ja kontaktläätsed- paljude inimeste unistus. Nüüd saab selle kiiresti ja turvaliselt teoks teha. Uued võimalused laserkorrektsioon nägemine avatakse täiesti kontaktivaba Femto-LASIK tehnikaga.