Gyperandrogeneerimine naistel Full Cure. Munasarjade genessi gyperandrogeneerimine. Hüperandrode ravi
Naise organismis hormonaalse tasakaalu patoloogiline seisund, milles meeste suguelundite hormoonide liigne tootmine - androgeenid on hüperaatenia nimi. Haigus on seotud töö rikkumisega endokriinsüsteem. Hüperandrogenereerimise sündroom täheldatakse umbes 5-7% naistest, umbes 20% neist ei saa rasestuda ega lapse taluda.
Tavaliselt toodetakse a androgeene seksuaalsete asutuste poolt summas, mis tagab juuste katte kasvu kubeme ja kaenlaaluse piirkonnas, kliitori, õigeaegse puberteedi ja seksuaalse atraktsiooni moodustamises. Androgeenid vastutavad maksa ja neerude tavapärase töö eest.
Androgeeni aktiivseks tööks esineb noorukieas sekundaarsete seksuaalsete tähiste moodustamise ajal. Täiskasvanueas on androgeenid luukoe tugevdamiseks vajalikud. Hormoonide ülemäärane põlvkond toob siiski patoloogilisi muutusi, mis oluliselt halvendavad naiste elu kvaliteeti. Kõige kahetsusväärsemad tulemused hõlmavad. Sellistel juhtudel on ravi vajalik, mis aitab kaasa hormonaalse tausta normaliseerimisele.
Sündroomi sordid ja põhjused
Androgeeni valmimise protsess toimub munasarjades ja neerupealistes näärmetes. Tavaline kogus toodetud hormoon ja selle õige östrogeeni suhe annab hormonaalse tasakaalu, mis on vajalik keha täieliku toimimise jaoks.
Sõltuvalt patoloogia päritolust eristatakse mitmeid vorme:
- Hüperandrode munasarjade genees - esineb polütsüstiliste munasarja sündroomis. Põhjuseks on hüpotalamuse hüpofüsiumsüsteemi rikkumine. Rikkumine on pärilik.
- Neerupealise genesi hüperandrogeenimine on põhjustatud neerupealiste ajukoore töö rikkumisest. Haigus on kaasasündinud iseloom ja see võib põhjustada ka kasvajatest (incelko-cushing's tõbi). Sel juhul algab esimene igakuine hilja, halva heakskiidu ja aja jooksul võivad nad üldse peatuda. Teised iseloomulikud märgid - Akne arvukus selja- ja rindkere valdkonnas, piimanäärmete vähene areng, meeste tüübi kujunemine, kliitori suurenemine.
Mitmed patsiendid diagnoositakse hüperandrode segatud geenid. Sellisel juhul häirib organismi samaaegselt munasarjade ja neerupealiste näärmete toimimist. See patoloogia põhjustab hüpotalamuse ja neuroendokriinsed häired. Hormonaalse tasakaalu ebaõnnestumisi süvendab vegetatiivseid neurootilisi häireid. Mõningatel juhtudel diagnoositakse madala rõhuga hüperandrode, milles androgeenide näitajad vastavad normile ja ei tuvasta kasvajate esinemist siseorganites.
Segavorm takistab esinemissageduse rasedust ja muudab lapse edukaks kuivamiseks võimatuks.
Arvestades ületamise määra lubatav tase Androgeen, eristage adrenogeeni sündroomi absoluutset ja suhtelist vormi. Esimesel juhul ületab meeste hormoonide kontsentratsioon lubatud normid. Suhteline hüperandrode diagnoositakse meeste hormoonide lubatud näitajaid. Samal ajal on naiste elundite ja näärmete suurenenud tundlikkus nende mõjudele.
Kokkuvõttes saab eristada järgmisi selle sündroomi peamisi põhjuseid:
- androgeenide sünteesevastase ensüümi ebaõige tootmine, mille tulemusena esineb nende liigne kogunemine kehas;
- neerupealiste kasvajate olemasolu;
- haigused ja ebaõnnestumised munasarjade töös, mis tekitavad liigset androgeeni;
- kilpnäärme patoloogia (hüpoterioos), hüpofüüsi kasvajad;
- pikaajaline steroidide vastuvõtmine professionaalsete klasside ajal jõulistes spordialadel;
- rasvumine lapsepõlves;
- geneetiline eelsoodumus.
Munasarjade tööhäiretega, neerupealiste ajukoore suurenemine, naharakkude ülitundlikkus testosterooni, suguelundite kasvajate toimele kilpnäärme Võib-olla arengu patoloogia ja lapsepõlve.
Kaasasündinud hüperandrogeenimine ei võimalda mõnikord sünnipäeva põranda installimist täpsust. Tüdrukul võib olla suured seksuaallaimused, suurenevad peenise kliitori suurusele. Sisemise suguelundite välimus vastab normile.
Üks adrenogenitaalide sündroomi sortidest on üksildane vorm. Haigus on pärilik looduses ja see ilmneb tavaliselt lapse elu esimestel kuudel. Neerupealiste ebarahuldava töö tulemusena ilmuvad oksendamine, kõhulahtisus, krambid.
Vanemas vanuses hüperandrode põhjustab liigse juuste kasvu kogu keha, viivitus moodustumise piimanäärmete ja välimus esimese igakuine.
Kliinilised ilmingud
Sümptomid võivad varieeruda väikesest (liigse juuste kasv kehas) raskeks (sekundaarsete meessoostide suguelundite arendamine).

Naiste hüperandrogeenimise kliinilised ilmingud akne ja meheliku proovide vormis
Patoloogiliste häirete peamised ilmingud on järgmised:
- akne - esineb suurenenud rasuse nahaga, mis viib rasumaste näärmete ummistuse ja põletikuni;
- seborröa peanahk;
- girsutism on tugeva vaikuse tekkimine ebatüüpiliste kohtade kohtade jaoks (nägu, rindkere, kõht, tuharad);
- harvendamine ja juuksed kadu peaga, kiilas välimus;
- tõhustatud lihaste kasvu, lihaste moodustumine meeste tüübile;
- häälde kärpimine;
- , vaesus, mõnikord täielik menstruatsiooni lõpetamine;
- kõrgenenud seksuaalne atraktsioon.
Hormonaalse tasakaalu saavutamine on põhjustatud diabeedi väljatöötamisest, liigse kaalu välimuse, lipiidide metaboolsete häirete tekkimisest. Naised muutuvad erinevatele nakkushaigustele väga vastuvõtlikuks. Nad arendavad sageli depressiooni, kroonilist väsimust, suuremat ärrituvust ja üldist nõrkust.
Hüperandrode üks kõige tõsisemaid mõjusid on viriliseerimis- või viriliseeritud sündroom. Nn arengu patoloogia naine organismkus ta omandab hääldatud meeste märke. Viriliser viitab haruldasetele kõrvalekalletele, see diagnoositakse ainult ühel patsiendil 100-st, mis teatab kehale ülemäärase juuste kasvu.
Naine moodustatakse suurema lihaste kasvuga meessoost näitaja, igakuine lakkab, kliitori suurust suurendatakse oluliselt. Väga sageli arenevad sellised märgid naistel, kes kontrollimatult astuvad steroidid, et suurendada spordi vastupidavust ja füüsilist jõudu.
Diagnoosi loomine
Patoloogilise seisundi diagnoos hõlmab patsiendi välist ja günekoloogilist uurimist, analüüsides selle kaebusi üldise heaolu eest. Pöörake tähelepanu menstruaaltsükli kestusele, liigse pikendamise, kehamassi indeksi lokaliseerimisele, suguelundite välimusele.
Milliseid katseid tuleks anda androgeenide taseme määramiseks?
Arstid (günekoloog, endokrinoloog, geneetika) nimetavad järgmised uuringud:
- testosterooni, folliculli hormooni, prolaktiini, estradiooli ja kortisooli taseme määramine uriinis;
- proovid dekstasooniga, et määrata sündroomi arengu põhjuse määramiseks;
- Ultraheli munasarja ja neerupealiste;
- Ct hüpofüüsi
- glükoos, insuliini, kolesterooli.
Ultraheli väikeste vaagnaorganite määrab võimaliku kättesaadavuse. Analüüsimine on vajalik erinevate haiguste määramiseks.
Uurimismaterjalid võtta hommikul tundi enne sööki. Kuna hormonaalset taust eristub ebastabiilsusega, võetakse täpse diagnostika puhul kolm proovi katkestustega vähemalt pool tundi. Soovitav on menstruaaltsükli teisel poolel testid teha, lähemale menstruatsiooni hinnangulisele algusele.
Ravi põhimõtted
Hüperandrode ravi peaks olema terviklik ja esiteks, mille eesmärk on kõrvaldada probleeme ja haigusi, mis toimivad provotseerivate teguritena. Selliste haiguste loetelu sisaldab kilpnäärme patoloogiat, polütsüskatse munasarja sündroomi, adrenogenitaalse sündroomi.
Kasutusmeetodite valik sõltub patoloogia vormist ja selle eesmärgi kujul, et teraapia tagakiusab (võitlus girsutismi vastu, taastades reproduktiivse funktsiooni, raseduse säilitamise raseduse ohust).
Peamised terapeutilised meetmed hõlmavad järgmist:
- ravimiteraapia;
- kirurgiline sekkumine;
- traditsioonilise meditsiini vahendite kasutamine;
- toitumise ja füüsilise pingutuse normaliseerimine.
Konservatiivravi
Seda kasutatakse toodetud meessoost hormooni koguse vähendamiseks ja nende ülemäärase tegevuse aitavate protsesside koguse vähendamiseks. Kirurgilise sekkumisega munasarjade hüperandrode põhjustavate suguelundite kasvajate olemasolu.
Kui naine ei kavatse lähitulevikus olla rase, kuid kannatab akne lööve ja ülemääraste karvade all, et nendest sümptomitest vabaneda, on ette nähtud antiandogeense toimega (näiteks Diana 35).
Sarnased ravimid mitte ainult kõrvaldavad ebameeldivaid välismärgidKuid kaasa ka menstruaaltsükli normaliseerimisele. Kosmeetilise toime puhul määratakse põletikuvastased salvid, mis vähendavad naha soolade tootmist.
Ravi rasestumisvastaste vahendite kasutamise vastunäidustuste juuresolekul kasutatakse ravi jaoks spironolaktooni. See on ette nähtud enneaegse sündroomi tõsise menetluse ja polütsüstiliste munasarjadega. Ravim kohtleb edukalt akne ja karvakasvu.
Analoogravim on Veroshirion. Tema peamine asi toimeaine Samuti on supironolaktoon. VEROSOSHPIPON'S vastuvõtt on äärmiselt ebasoovitav, ilma et oleks ilma koordineerimata kasutusaja kestusega ja vajalik annus.
Kui Hypradroidrodium on tingitud ensüümi puudumisest glükokortikoidide androgeenide konverteeriva ensüümi puudumisest, kuvatakse see meetod normaliseerimiseks. Suurema efektiivsusega on metiPred. Vormide oma vabastamise tablette ja pulbrid süstimiseks. Vahendid on vastunäidustatud nakkuslike ja viirushaiguste, tuberkuloosi, südamepuudulikkuse juuresolekul. Ravi kursuse ja annuse kestus määrab arsti.

Ettevalmistused, mida kasutatakse hüperandrode raviks
Üks edukaid meetodeid konservatiivne ravi on madala kalorsusega dieet. Üleliigse kaal on vaja vabaneda, mis sageli raskendab haiguse kulgu ja toob naisele täiendavat psühholoogilist ebamugavust.
Iga päev kasutatavate kalorite koguarv ei tohiks ületada 2000. aastal. Sellisel juhul on piisava kehalise aktiivsusega tarbitud kalorite arv tarbitavate kalorite arv väiksem kui tarbitavad, mis toob kaasa järkjärgulise kaalulanguse.
Hüperandrodes näidatud toitumine annab erandi õlise, soola ja ägeda toidu dieedile, samuti alkoholi, kastmete ja rasvaväljade toitumisest.
Põhimõtete järgimine Õige toitumine Tugevdatud regulaarse spordiga. Kasulik jooksmine, aeroobika, ujumine, aktiivne mängud värskes õhus.
Võitlus girsutismi vastu viiakse läbi erinevate kosmeetiliste protseduuride abil: eemaldamine vaha, depilatsiooni, soovimatute juuste kõrvaldamisega laseriga.
Traditsioonilise meditsiini kasutamine
Ravi folk õiguskaitsevahenditega on täielikult kohaldatav ravimiravi kompleksis, kuid ei ole traditsiooniliste meetodite täieõiguslik asendaja.
Populaarsed retseptid:
- Dononi, salvei, Labazniku ja võrdsete fraktsioonide kõrvaldamisetaimed segatakse, valatakse 200 ml vett, hoidke veel 20 minutit ja filtreeritakse veevannis. Saadud keetmisele lisatakse 1,5 ml roodiumi roosa tinktuuri. Võtke keetmine kolmandiku klaasist mitu korda päevas enne sööki.
- 2 supilusikatäit purustatud pööret, 1 lusikatäis Yarrow ja värvimine valatakse keeva veega, nõudma umbes tund, filtreerige. Võtke hommikul pool klaasi tühja kõhuga hommikul ja enne magamaminekut.
- Mitmed supilusikatäit kuiv lehtede nõges valatakse klaasi veega, nõuda suletud ass, filtreerige. Võtke supilusikatäis mitu korda päevas.
- Rosehip puuviljad, must sõstar valatud keeva veega, nõuda umbes tund aega. Seejärel lisage väike mesi. Saadud kokteil juua mitu korda päevas pärast söömist.
Kõige sagedasemate seas folk õiguskaitsevahendeid Günekoloogilise sfääri haiguste vastu võitlemisel - igav emakas. Seda kasutatakse koos teiste paranemisvahenditega keedu- või tinktuuri kujul.
- 100 g igav emaka vala 500 ml viina ja nõuda 2 nädalat. Võtke tinktuur 0,5 tl kolm korda päevas.
- 2 supilusikatäit boroval emaka vala klaasi keeva veega, nõudma umbes tund aega. Joo väikesed osad päeva jooksul.
- 100 g rohelist kooritud pähkleid ja igav emakas segu 800 g suhkruga, lisage sama palju viina. Pudel koos segu panna pimedas kohas 14 päeva. Pärast sulgemist võtke teelusikatäis pool tundi enne söömist.
Androgeenide arvu vähendamiseks kasutatavate MINT-i kasutamiseks. See põhineb tinktuuridel ja teedel. Suurema tõhususe saavutamiseks saate piparmündile jama. Normaliseerib naissoost hormonaalse tasakaalu regulaarselt rohelise tee vastuvõtmist.
Kuidas ravida probleemi meditsiinilised maitsetaimed Ja ühendage see meetod teiste ravimeetoditega, ütleb alati arstile. Sa oled lubamatu eneseravimite tegemiseks!
Hüperandrode ja viljatus
Androgeenide liigne androgeenide liigneb sageli takistuseks raseduse teretulnud.
Kuidas rasestuda ravimiteraapiaga ja kuidas see on reaalne?
Viljatuse ravi antud juhul on suunatud narkootikumide kasutamisele munasarjade saagise väljundi stimuleerivate ravimite kasutamisele. Selle näide narkootikum Võib-olla clomiphene.

Üks kõige rohkem tõhusad ravimidKasutatakse ovulatsiooni stimuleerimiseks ja menstruaaltsükli normaliseerimiseks Duphastoni. Pärast raseduse tekkimist jätkatakse ravimit raseduse katkemise vältimist ja normaliseerimist raseduse arengut.
Kui stimulatsioon on ebaefektiivne, soovitavad arstid nõuda kirurgilist ravi. Meetod on laialdaselt kasutatav kaasaegset meditsiini. Selle protseduuri käigus tehakse munasarjade ekstsisioon, et aidata "väljumiseks" küpse muna. Tõenäosus rasedaks pärast laparoskoopiat on suurem, seda vähem aega läbib töö päevast. Maksimaalset mõtlemisvõime tähistatakse esimese kolme kuu jooksul.
Aga pärast edukalt kontseptsiooni, hüperandrogeenimise olemasolu võib takistada lapse sisenemist edukat. Liigne meeshormoonid põhjustavad sageli asjaolu, et puuviljamuna Ei saa emakas hoida. Kinnituse tõenäosus säilitatakse kõrge.
Ohtlikud raseduse nädalad hüperandrodes on ajavahemik kuni 12. nädalani ja pärast 19. aastat. Esimesel juhul toodavad hormoonid platsenta poolt ja pärast 19. nädalat saavad nad vilja ise toota.
Raseduse säilitamiseks on patsient ettenähtud deksametasoon (metipipe). See aitab vähendada androgeeni taset. Doseerimine ravimi valib ainult arsti poolt!
Paljud tulevased emad on väga kardavad ravimi kõrvaltoimeid ja hirmu, et see võib põhjustada kahju, mis ei ole veel sündinud beebi. Palju aastaid kogemusi see ravim See tõestab oma ohutust nii tuleviku arengu ja sündi voolu jaoks.
Enamikul juhtudel, et vältida riski nurisünnituse, arstid soovitada kõigepealt läbida täieliku ravi käigus ja seejärel planeerida rasedust. Kui naine ei suuda lapse ette kujutada, võib-olla.
Ärahoidmine
Hüperandrode'i spetsiifilisi ennetusmeetmeid ei ole, kuna see sündroom arendab hormonaalsel tasemel.
Kokku ennetusmeetmed hõlmavad järgmist:
- ratsionaalne toit, mis sisaldab menüütoodetes, mis on rikas koes, kaalu kontroll;
- suitsetamisest keeldumine ja alkoholi kuritarvitamine;
- regulaarne külastamine günekoloogi;
- narkootikumide ja rasestumisvastaste vahendite vastuvõtmine alles pärast arsti soovitust;
- kilpnäärme patoloogiate, maksahaiguste ja neerupealiste ravi õigeaegne ravi.
Hüpendrogeenimine ei ole ainult naha, juuste ja menstruaaltsükli probleemid. See on keha ühine haigus, mis ei võimalda naisel juhtida kvaliteetset eluviisi ja kaotab sageli oma emade rõõmud. Kaasaegsed meetodid Diagnostika ja ravi võimaldavad meil tuvastada patoloogia aja jooksul ja edukalt kõrvaldada oma ilmingud.
Volitus:Fishilin A.A., Karpova E.A. Munaraalne hüperandrode ja metaboolne sündroom // RMG. 2001. №2. P. 93.
Endokrinoloogiline teaduslik keskuse Ramna, Moskva
Alates Neehrogen Genesise või Hyperandogeense düsfunktsiooni munasarjade hüperandogeerimine, mida varem nimetatakse kevadel - levental sündroom, on praegu vastavalt WHO klassifikatsioonile, mis on kuulsamad maailmakirjanduses polütsüstiline munasarjade sündroom (SPE).
SPE kliiniline pilt ilmneb kroonilise arongiohi nikarikute või kollase korpuse väljendunud hüpofunktsiooni poolt, mis toob kaasa munasarjade suuruste kahepoolse suurenemise valguse kesta paksenemise ja skleroosiga. Need muutused avaldub menstruaalfunktsiooni rikkumise teel - opsomeeter, amenorröa, kuid Metragia arendamine ei ole välistatud. Folliikulogeneesi häired põhjustavad inhibutse primaarse või sekundaarse viljatuse arengut.
Üks peamisi diagnostikakriteeriume SPI on hüperakeneemia - androgeensete steroidide taseme tõstmine veres (nagu testosteroon, androstendioon), mis toob kaasa hirsutismi ja teiste androgeeni sõltuvate dermattide arendamisele.
Rasvumine või liigne kehakaal sageli kaasas SPI. Kehakaalu indeksi (BMI) määramine võimaldab teil kindlaks määrata rasvumise aste. Vöö ja reide mõõtmine (OB) näitajad ja nende suhe näitab rasvumise tüüp (kõhu tüüpi rasvumine on prognostiliselt ebasoodne, kus alates / umbes\u003e 0,85).
Lisaks peamistele haiguse sümptomitele määrab kliiniline pilt suuresti üldise vahetushäirete abil, nagu dislibideemia, süsivesikute häiritud vahetamine, suurenenud risk hüperplastiliste ja kasvaja protsesside tekkimise oht suguelundite kaudu. Düslipideemia on suurendada triglütseriidide taset, kolesterooli, madala tihedusega lipoproteiini, väga madala tihedusega lipoproteiini ja suure tiheduse lipoproteiinide vähenemist. Need rikkumised põhjustavad aterosklerootiliste muutuste varajase arengu riski, \\ t hüpertensiivne haigus ja isheemiline haigus Südamed.
Süsivesikute metabolismi häirimine seisneb insuliiniresistentsuse-hüperinsulinmia kompleksi väljatöötamisel, mis on hiljuti olnud patogeneetiliste SPI arengu lingide uurimisel peamine suund.
60ndatel on SPI patogenees seotud munasarjade 19-hüdroksülaasi ja / või / või 3b-dehüdrogenaasi primaarse ensümaatilise defektiga, ühendades need häired primaarse polütsüstilise munasarja haiguse kontseptsiooniks. Järgnevate aastate töödes ilmnes siiski, et graanulite rakkude aromataasi aktiivsus on FSH-sõltuv funktsioon.
Ilmnenud Sveti kõrgendatud tase Lutotening hormoon (LH), puudumine oma ovulatoorse piik, normaalne või vähendatud follicularityhormoonihormooni (FSH) puudumine LH / FSH (2,5-3) häirete suhte vähenemise ajal (2,5-3) ei võtnud alghäireid steroidogeneesi gonadotroopilise reguleerimise munasarjade koes Sekundaarse munasarjade polütsütsüstide väljatöötamisega.
Kuni 80-ndate keskpaigani leiti SSC jeen teooria), et SPE patogeneesi algmehhanism on androgeenide liigne sünteesi neerupealiste neerupealiste sünteesiga Adrenarcle'i ajavahemiku jooksul neerupealiste muutunud tundlikkuse tõttu ACTH või Meshi neerupealiste ajutsooni liigne stimulatsioon ei ole ATG-sarnane tegur või B--sendorfiinide, neurotransmitterite, näiteks dopamiini mõju all. Jõudes kriitiline mass Kehad (eriti selle normi ületavad) suurendab androgeenide perifeerset konversiooni östrogeenides, peamiselt maksas ja rasvkoes. Estrogeeni taseme suurendamine, peamiselt östrooni, toob kaasa gonadotroofide hüpersenseerumise LULIGERINiga (GNV) suhtes. Samaaegselt Estroni tegevuse all suureneb GNVG hüpotalamuse tootmine, selle sekretsiooni impulsside amplituud ja sagedus suureneb, mille tulemusena on LG adenogipiidismi tooted häiritud LG / FSH suhteid FSH suhteline ebaõnnestumine toimub. LH mõju tugevdamine munasarjadele aitab kaasa tekstuurrakkude ja nende hüperplaasia androgeeni toodete suurenemisele. Umbes madal tase FSH toob kaasa FSH-sõltuva aromataasi aktiivsuse vähenemise ja granuloosirakud kaotavad võime korraldada androgeenide östrogeenides. Gyperandrogeneerimine takistab folliikulite normaalset kasvu ja aitab kaasa nende tsüstilise atresia moodustamisele. Folliikulite kasvu puudumine ja valmimine veelgi rohkem pärsib FSH sekretsiooni. Perifeersete kudede suurenenud androgeeni bassein muundatakse estrooniks. Nõiaring on suletud.
Seega on steroidogeneesi reguleerimise kesk- ja perifeersete mehhanismide rikkumise tulemus une funktsionaalse munasarjade hüperandrogeenimisega patsientidel.
Patogenees SPA S.S.C. Jeen on esitatud skeemil 1:
Skeem 1.
80-ndate aastate alguses pakkusid mitmed autorid polütsüstiliste munasarjade sündroomi patogeneesi uut teooriat, mis erineb S.S.C. teooriast. Jeen. Leiti, et SPI seostati hüperinsulseemiaga ja see sündroom on iseloomulik nii reproduktiivse funktsiooni kui ka metaboolsete protsesside rikkumisele.
Hüperinsulaamia ja hüperaatenia vaheliste suhete esinemine oli märgitud 1921. aastal, achard ja thieris. Nad kirjeldasid hüperandrode naises rasvumise ja 2-tüüpi suhkru diabeedi all kannatanud naise ja nimetatakse selle riigi "habemeta naiste diabeet".
Tulevikus avastas D. Tarnen, et Naised SPI ja hüperandrogeeniga tähistatud basaal- ja glükoosimuleeritud hüperinsulinmia võrreldes sama kaaluga naiste juhtrühmaga, mis eeldas insuliiniresistentsuse. Otsene sõltuvus insuliini taseme ja androgeenide vahel ilmnes ja soovitati, et hüprandrogeenimine võib olla hüpelandi põhjus.
1988. aastal näitas G. Reaven kõigepealt, et IR-i ja kompenseeriva hüperinsulseemia (GI) mängivad olulist rolli metaboolsete häirete sündroomi arendamisel. Ta kutsus seda "Sündroom X" . Praegu on termin "metaboolne sündroom" või "insuliiniresistentsuse sündroom" kõige sagedamini tarbitud.
Hüperinsulisteemia ja hüperandrode patogeneesi hüpotees Hüperandrode ja hüperinsulineemia esinemise mehhanismi ei ole lõpuks uuritud. Kolm koostoime valikud on teoreetiliselt: hüperandrode (ha) põhjustab GI; GI toob kaasa ha: Mõlema nähtuse eest vastutab mõni kolmas tegur.
1. Eeldus, et HA on põhjustatud GI-lt järgmistest asjaoludest. Naistel, kes võtavad suukaudseid rasestumisvastaseid vahendeid, mis sisaldavad progestiinid "androgeensete omadustega", tuvastatakse glükoositaluvuse rikkumine. Testosterooni transseksuaalse pikaajalisel määral on kaasas IL-i tekkimine. On näidatud, et androgeenid mõjutavad lihaskoe koostist, suurendades teise tüüpi lihasskiudude kogust, vähem tundlikku insuliini suhtes võrreldes esimese tüübi kiududega.
2. Enamik tegureid tunnistavad, mida KI toob ha. Näidati, et IR-i säilitati patsientidel, kes allutati, allutati ja kogu munasarjade eemaldamist, samuti naistel, kes kasutasid GNVG agonistide pikka aega, kui androgeenide taseme väljendunud edusamme täheldati. Diasoksiidi eesmärk - ravim, mis pärsib pankrease rauda insuliini, põhjustas testosteroonitaseme (t) vähenemise ja suurendades seksistri siduva globuliini (USSG) taset une, rasvumise ja hüperinimeemiaga patsientidel. Intravenoosne insuliini intravenoossed naised SPE-ga tõi kaasa ringleva Androtandiooni ja T-sündmuste taseme suurenemisele, mille eesmärk on parandada insuliini tundlikkust (kaalulangus, nälg ja madala kalorsusega dieedi) androgeeni taset vähenemist. On tõendeid, et insuliini saab otseselt pärssida tooteid USSG maksaga ja hüperinsulisteemia tingimustes See mõju suureneb. Samal ajal arvatakse, et insuliini ja mitte suguhormoonid on USSG sünteesi peamine regulaator. USSG taseme vähenemine toob kaasa vaba ja seetõttu bioloogiliselt aktiivse t (normaalselt 98% t on assotsieerunud olekus) suurenemine.
Hüpotees, mis seob hektareid hüperinsulseemiaga, ei vasta küsimusele, kuidas munasarja säilitab insuliini suhtes tundlikkust organismi insuliiniressendis olekus. Pakutakse mitmeid võimalikke selgitusi. Kuna insuliinil on palju funktsioone, võib eeldada mõnede nende selektiivset defekti. Insuliini tundlikkuse orgaanil võib täheldada. Kuid see on tõenäolisem, et insuliini toimib munasarjaga mitte ainult insuliiniretseptorite kaudu, vaid ka insuliini sarnaste kasvufaktorite retseptorite kaudu (IFR).
Insuliini retseptorid ja IFR-1 retseptorid on inimese munasarjades tuvastatud (munasarjade tervislike naiste stromaalses koes, unega naised folliikulises koes ja granloosirakkudes). Insuliin võib võtta ühendust IFR-1 retseptoritega, kuigi vähem afiinsusega kui oma retseptoritega. Kuid GI-ga, samuti olukorras, kus insuliiniretseptoreid blokeeritakse või puudujääki, võib eeldada, et insuliini suhtleb IFR-1 retseptoritega suuremal määral.
Võib-olla võib insuliini / IFR-1 steroidogeneesi stimulatsiooni mehhanisme munasarjasse jagada mittespetsiifilisteks ja spetsiifilisteks. Mittespetsiifiline koosneb glükoosi metabolismi, aminohapete ja DNA sünteesi klassikalises toimel. Selle tulemusena suureneb rakkude elujõulisus ja seetõttu suureneb hormoonide sünteesi. Konkreetsed mehhanismid hõlmavad insuliini / IFR-1 otsest toimet steroidogeensete ensüümide, sünergia insuliini ja LH / FSH ja mõju retseptorite arvule LH-le.
Insuliini / IFR-1, sünergistlikult FSH-ga stimuleerivad aromataasi aktiivsust granolasirakkude kultuuris ja suurendades seeläbi östradiooli sünteesi. Lisaks toovad need kaasa LH retseptorite kontsentratsiooni suurenemisele, tugevdades Teska ja stromaalsete rakkude Androtandiooni LG-sõltuva sünteesi.
Androgeenide kasvav kontsentratsioon munasarjas insuliini / IFR-1 toimel põhjustab folliikulite atesiaatiat, mis toob kaasa östrogeeni ja progesteri tootvate granloosirakkude järkjärgulise kõrvaldamise, millele järgneb munanditerakkude hüperplaasia ja luteiniseerimine Vahekoe munasarja, mis on tootmise koht androgeeni. See selgitab asjaolu, et insuliini munasarjade steroidogeneesi stimuleerimine ilmneb peamiselt hüperandrode vormis.
Soovitati, et insuliini / IFR-1 võiks stimuleerida nii tsütokroom P450S17A LG-sõltuvat aktiivsust munasarjades ja P450S17A ActP-sõltuva aktiivsusega neerupealistes. Ilmselt selgitab ilmselt unehüperandrode munasarjade ja neerupealiste vormide sagedast kombinatsiooni.
Seal on ka suhe S.S.C. teooriaga Jeen osalemise neerupealiste steroidogeneesi patogenees SPE (skeem 2).

Skeem 2. Insuliini toime polütsüstiliste munasarjade sündroomiga
V. INSLER (1993), uurides insuliini taset, IFR-1, kasvuhormooni ja nende korrelatsiooni gonadotropiini taset ja androgeenidega naistega SPE, tegi ettepaneku selle sündroomi arendamiseks kavandasid kahte mudelit selle sündroomi arendamiseks. Rasvumisega patsientidel põhjustab see androgeenide ülemääraseid tooteid IFR-1 retseptorite kaudu, mis sünergias LG-ga põhjustavad tsütokroom P450S17A aktiivsuse suurenemise androgeeni sünteesi peakontrolli ensüümi aktiivsuse suurenemise. Tavalise kehakaaluga patsientidel stimuleerib kasvuhormooni kontsentratsiooni suhteline suurenemine IFR-1 liigseid tooteid. Sellest hetkest on sünergism LH-ga kaasa androgeenide hüperproduktsioonile vastavalt mehhanismile nagu rasvumisega patsientidel. Androgeenide taseme tõus põhjustab hüpotalaamiliste keskuste funktsiooni muutuse, mis toob kaasa gonadotropiinide sekretsiooni rikkumise ja tüüpilise une muutuste jaoks (skeem 3).

Skeem 3. Polütsüstilise munasarjade sündroomi patogenees
3. Siiski on mitmeid tuntud IR riike, mis ei ole seotud HA, näiteks lihtne rasvumine ja 2. tüüpi 2. tüüpi. Selgitama, miks mitte kõik rasvumise ja GI-ga patsiendid arenevad hüperandrode ja SPI-s, geneetilise eelsoodumuse olemasolu hüpotees insuliini stimuleeriva mõjuga androgeenide sünteesile munasarjas . Ilmselgelt on geen või geenide rühm, mis muudavad naise munasarjad SPI-dega tundlikumaks stimulatsiooni insuliini androgeeni toodete suhtes.Molekulaarsed mehhanismid, mis põhjustavad insuliiniresistentsuse arengut, mitte täielikult uuritud. Kuid viimased saavutused molekulaarbioloogia valdkonnas võimaldas kindlaks määrata geeni struktuuri, mis kodeerib retseptori insuliini munasarjade hüperandrogeeniaga naistel.
Moller ja Flier uuris aminohapete järjestust munasarjade hüperandrogeeniaga patsientidel DNA ahelate struktuuris. Nad leidsid välja trüptofaani asendamise somoziinis koodis 1200. Teadlased näitasid, et selline muutus rikub insuliiniretseptori türosiinkinaasi süsteemi aktiveerimisprotsessi. Insuliiniretseptorite madal aktiivsus toob kaasa IR-i ja kompenseerivate GI arengu.
Yoshimasa et al. Teine variant punkt mutatsiooni patsiendi hüperagratenia, insuliiniresistentsuse ja musta akanthoosi kirjeldati. Nad leidsid insuliiniretseptori tetrameeri struktuuris arginiini seriini asendamise. See aktiivse lookuse mutatsioon viis ühendite võimatuseni A- ja B-subühikute võimatuseni, mille tulemusena ei sünteesiti funktsionaalselt aktiivset retseptorit. Uuritud uuringud on ainult esimesed katsed tuvastada munasarjade stromaalse teomatoosi spetsiifiline geneetiline etioloogia.
Hiljem, Dunaif A. märgib, et Sündroomi polütsüstiliste munasarjade munasarjade võib olla tingitud haigusest autofosforüülimise insuliiniretseptori B-subühikud (IR), tsütoplasmaatilise osa milles on türosiinkinaasi aktiivsus. Sel juhul insuliini sõltuva fosforüülimise seriinijääke (Sleep-Ser) suureneb türosiinkinaasi aktiivsuse pärssimisega (sekundaarse signaali saatja, mis määrab insuliini tundlikkuse sama nime retseptoritele). See defekt on iseloomulik ainult SPE-sõltuva IL-i jaoks teiste insuliiniresistentsete riikidega (rasvumine, insd), neid muudatusi ei tuvastata.
On võimatu välistada, et kui SLE-SER on seeria-fosforüüliv tegur. Näiteks eraldatakse seriin / treenimisfosfataasi inhibiitor, mis ilmselt häirib IL fosforüülimist SPI-SER-ga. See ühend on sarnane PC-1 (inhibiitori türosiinkinaasi insuliini retseptori hiljuti spetsiaalse membraani glükoproteiiniga, kuid viimane ei suurenda insuliini sõltuvat fosforüülimist seriini IR.
Sellistel omadustel on kasvaja-nekroosifaktor (TF-a): seriinjääkide fosforüülimine IRS-1 (üks IR-signaali sekundaarse saatjaid) FNO-a mõjuga kaasneb IL-i türosiinkinaasi aktiivsuse pärssimine.
Moller et al. Leiti, et inimese seriini P450S17 fosforüülimine, neerupealiste ja munasarjade biosünteesi reguleeriva võtmeensüümi, suurendab 17,20-Liazi aktiivsust. Steroidogeneesi ensüümi aktiivsuse moduleerimist seriini fosforüülimise tõttu kirjeldati 17B-hüdroksücenoiddehüdrogenaasi jaoks. Kui me eeldame, et sama teguri (ensüümi) fosforüülib seriininsuliini retseptori, põhjustades IR ja seriin P450s17, põhjustades hyparandrode, siis saate seletada suhe SPI ja IR. In vitro eksperimendid Siin näidati, et valgu kinaasi a (seriin / treoninkinaas) katalüüsib seriininsuliini retseptorite fosforüülimine (skeem 4).

Skeem 4. Insuliiniresistentsuse geen SPI-ga
Leptiini roll unegaHiljuti mitmed uuringud viiakse läbi bioloogiline roll Leptiin, kelle tulemused on julgustavad. Olles valguhormoon, leptiin mõjutab toidu käitumist ja tal on lubav mõju puberteedi algatamisele loomadel. Selle hormooni roll metabolismi reguleerimisel ja inimeste paljunemisfunktsiooni reguleerimisel ei ole lõpuks lõplikult selgitatud. Sel põhjusel andmeid leptiini taseme kohta munasarjade gyperandrogeenimisega koos insuliiniresistentsusega ja nende rolli idee nende muutuste arendamisel on väga vastuolulised.
Hiljuti on leptiini bioloogilisel rollil läbi viidud mitmeid uuringuid, mille tulemused on julgustavad. Olles valguhormoon, leptiin mõjutab toidu käitumist ja tal on lubav mõju puberteedi algatamisele loomadel. Selle hormooni roll metabolismi reguleerimisel ja inimeste paljunemisfunktsiooni reguleerimisel ei ole lõpuks lõplikult selgitatud. Sel põhjusel andmeid leptiini taseme kohta munasarjade gyperandrogeenimisega koos insuliiniresistentsusega ja nende rolli idee nende muutuste arendamisel on väga vastuolulised.Niisiis, vastavalt Brinechaffa jt läbiviidud uuringu tulemustele. (1996), märkimisväärne osa naistest SPEA-s on leptiinitasemed kõrgemad kui nende BMI, vaba testosterooni, insuliinitundlikkuse tõttu oodatust. Teisest küljest ei ole hiljutine töö selles valdkonnas märkimisväärseid erinevusi uuritud rühmades SPE ja kontrollrühmadega uuritud rühmades. Lisaks leiti, et insuliini basaaltase, gonadotropiinide ja sugu steroidide sisaldus ei mõjuta leptiini sisaldust. Kuid Zachow ja Magffin (1997), võttes arvesse andmeid MRNA leptiini retseptori juuresolekul munasarjade koes, näidanud kindlaksmääratud hormooni otsest mõju rottide granulaasi steroidogeneesile in vitro. Samal ajal näidati IFR-1-ga leptiini annusest sõltuvat tohutut mõju, mis on võimendatud FSH-stimuleeritud sünteesi e 2 rakkude suurenemisega graanulite rakud. Need andmed kinnitavad hüpoteesi, mis suurendades leptiini taset rasvumisega inimestel võib olla vastuolus domineeriva folliikule ja ovulatsiooni valmimisele. Spicer ja Franciso (1997) Andmed, mis näitavad, et leptiini suurendades kontsentratsioonides (10-300 ng / ml) inhibeerib granuloosirakkude kultuuris insuliini sõltuvat E 2 ja progesterooni tooteid. See mõju on tingitud leptiini spetsiifiliste sidumissaitide olemasolust. Analoogia põhjal võib eeldada, et leptiini kõrge tase võib vähendada tundlikkust teiste sihtkudede tundlikkust endogeense insuliini toimele, mis põhjustab IL-i arengut rasvumises.
Diagnoosimine Munasarjade hüperandrode sündroomi diagnoos tüüpilise kliiniline pilt Raskusi ei ole. Esiteks on see menstruatsioonifunktsiooni rikkumine oligo tüüpi, variatsioonide või amenorröa, anoinilatsiooni ja selle primaarse või sekundaarne viljatus, Hirsutism, akne rikas, 40% patsientidest on rasvumine erinevad kraadid raskusaste. Günekoloogilises uuringus ilmneb munasarjade suuruse kahepoolne suurenemine, sageli hüpoplastilise emaka taustal.
Oluline koht SPEA diagnoosimisel Hormonaalsete uurimismeetodite hõivata Suunatud hüperandrode, selle allika tuvastamine ja gonadotroopsete hormoonide taseme määramine: LG ja FSH. SPE-dega patsientidel leitakse sageli LH taseme ülekaalus FSH-d, nende suhet rikutakse ja suureneb (üle 2,5-3). Prolaktiini tase on normaalne, kuigi 30% patsientidest on mõningane suurenemine.
Tase eritumise uriiniga kokku 17-CC koos SPI kõigub laialdaselt ja on vähe informatiivne. 17-COP fraktsioonide (DGA, 11-oksüdeeritud ketosteroidide, androsteroni, etiokunoloon) määratlus ei taga ka hüperandrode allika lokaliseerimise avastamist. Kinnitus munasarja allikas hüperandrode on suurendada taset androtendiooni (A) ja testosterooni (T) veres ja suurenemine suhe A / T. Hüpendrode neerupealise geneesi kinnitatakse, suurendades dehüdropiosterosterooni (DGA) ja selle sulfaadi (DGA-C) ja 17-oksüprogesterooni (17-oksüprogesterooni (17-р) suurendamisega veres. Hüperandrode allika lokaliseerimise selgitamiseks pakutakse välja erinevad funktsionaalsed katsed, mille suurim jaotus, mille levitamine sai proovi deksametasooniga, sünaktiku depoo.
Võttes arvesse uute patogeneetiliste linkide avastamist SPE arendamisel süsivesikute ainevahetuse seisundi hindamiseks on vaja teostada glükoosi taseme määramisel standardse glükoosi taluva testi (75 ml OS glükoosi kohta). ja immuno-reaktiivse insuliini (IRI). Tõendid insuliiniresistentsuse kasuks on ka BMI rohkem kui 25 ja rohkem kui 0,85, samuti dislibideemia.
Ravi Põhineb kaasaegne lähenemine et patogeneetiline ravi Spaa munasarjade kahjustuste taastamise põhimõte
See tähendab, et kõrvaldamine annovelation, mis omakorda toob kaasa hüperandrode vähenemise ja folitseogeneesi taastamise. Munasarjade Gyperandrogenimise etiopatogeneesi omaduste uurimine toob siiski järeldusele, et SPE piisava kohtlemise meetodite valik osutub keeruliseks ülesandeks.
Kombineeritud suukaudsed rasestumisvastased vahendid - Kõige sagedamini kasutatavad narkootikumide rühmas. Tegemismehhanism seisneb kõrgendatud LG-de supresseerimisel, normaliseerides LH / FSH suhte suurenemise CSG maksa sünteesi suurenemise. Pärast tühistamist saavutatakse "tagasilöögi efekt" hüpotalamuse-hüpofüüsifunktsiooni normaliseerimisel androgeenide hüperproduktsiooni vähenemine munasarjade koe poolt, folliiklarogeneesi normaliseerumisest ja ovulatsiooni taastumisest.
Ravi viiakse läbi vastavalt standardskeemile: 1 tablett päevas 5 kuni 25 päeva tsükli 3-6 kuud. Vajaduse korral korrake kursused. Siiski on teada, et östrogeen-gestagiini rasestumisvastaste vahendite pikaajaline tarbimine võib põhjustada hüperinsulseemiat, süvendades seeläbi peamist patogeneetilist linki SPI.
Mõned rasestumisvastased vahendid on nende koostises eelnevalt tuumaenergia geenid (nohysterone, Levonorger), millel on erineva kraadi androgeeni mõju, mistõttu nende komponentide sisaldavate ravimite eesmärk on pisutismiga patsientidel piiratud. Hüperandrode sümptomite sobivam kasutage suukaudseid rasestumisvastaseid vahendeid koos gestagenita ilma androgeeni toimeta.
On võimalik kasutada gestageenseid preparaate androgeensete omaduste kujul monoteraapia, eriti endomeetriumi hüperplaasia. Didrogesteroon on ette nähtud 1 tablett (10 mg) 2 korda päevas 14-16 kuni 25 tsükli kestus 3 kuni 6 kursust.
Kõige rohkem tõhus vahend Ovulatsiooni stimulatsioon SPE-ga on anti-östrogeenne ravim klomipencytrate . Anti-östrogeeni peamised mõjud on hüpofüüdelisuse ülitundlikkuse vähenemine GNRG toimele, LH tootmise vähenemisele, LG ovulatoorse heite indutseerimisele, ovulatsiooni stimuleerimisele. Ravim on ette nähtud 50 mg, 100 mg päevas 5 kuni 9 päeva tsükli kuni ovulatsiooni kogu testid funktsionaalse diagnostika, kuid mitte rohkem kui 3 aastat järjest. Hiljuti ilmusid trükised, mis mõjutavad komifenteid insuliini insuliini sarnaste kasvufaktorile. Nad märkisid, et ovulatsiooni ovulatsioon stimulatsiooni viiendal päeval (150 mg / päevas) määrati järkjärguline vähenemine (maksimaalselt 30%) IFR-1 taseme tasemest. Kuid paljudes teistes sarnastes uuringutes ei leitud insuliini basaaltaseme usaldusväärset vähendamist vastuseks klomifeeni kasutuselevõtule.
Antandrogeensete omadustega narkootikumide ilmumine on terapeutiliste võimaluste oluliselt laiendanud, kui SPE. Kõige laialdasemalt kasutatud Diana-35, mis sisaldas 35 mg etinüülöstradiooli ja 2 mg tsiproteroneatsetaati. Lisaks suukaudsete rasestumisvastaste vahenditele iseloomulikule tegevusele blokeerib ravim androgeeni toime sihtrakkude tasemel, eriti juuste folliikulid. Viimane viib hirsutismi vähenemiseni. Ravimit kasutatakse vastavalt standardskeemile 6 või enama tsükli suukaudsete rasestumisvastaste kursustena. Siiski on vaja märkida nende ravimite negatiivse mõju olemasolu lipiidide ja süsivesikute vahetustele, mis väljendub kolesterooli taseme, madala tihedusega lipoproteiinide suurenemises ning suurendades hüperinsulinmia, mis nõuab nende näitajate pidevat dünaamilist kontrolli. SPA-ga patsientidel. Ka Spironolactonil on ka antidrogeensed omadused, mida kasutatakse laialdaselt androgeeni sõltuvate dermatopite ravis.
Üks peamisi juhiseid kaasaegne ravi Ovaral hüperandrode on narkootikumide otsimine ja kasutamine ja vahendid, mille eesmärk on insuliiniresistentsuse ja kompenseeriva hüperinsulaamia kõrvaldamine.
Esiteks on need meetmed, et vähendada liigset kehakaalu kaalu: madala kalorsusega dieet (1500-2200 kcal / päevas), mis piiravad rasva ja kergesti seeditavaid süsivesikuid, soola tarbimise piiramist 3-5 g päevas, mõõdukas füüsiline aktiivsus Töörežiimi normaliseerimine ja puhkus. On võimalik kasutada narkootikume, mis aitavad kaasa CMT vähenemisele, näiteks orlistatile, inhibeerides selektiivselt seedetrakti lipaaside ("rasva blokeerija") või sibutramiini blokeerides norepinefriini ja serotoniini pöördrestüübi hüpotalaamilise keskuse sünapside "küllastuse" sünapside vastu . Suurenenud energiatarbimine (termogenees) on tingitud ka sünergistlikule suhtlusele norepinefriini ja serotoniini tugevdatud funktsiooni vahel keskosas närvisüsteem. Seda väljendatakse keskse selektiivse aktiveerimisega sümpaatiline mõju Kaudse aktiveerimise B3-adrenoretseptorite tõttu pruuni rasvakoe kohta.
Järgmine samm on ravimite kasutamine, mis parandavad kudede tundlikkust insuliini suhtes. Kirjanduses on andmeid hüperandrode vähendamise ja menstruatsiooni- ja ovulatoorsete funktsioonide taastamise kohta mitmete biguenside (metformiin / SIOFOR® / BERLIN-HEMI) ettevalmistamisel. Nad võimendavad insuliini toime retseptori ja postretseptori tasemel ning parandage oluliselt koe tundlikkust selle hormooni suhtes. Mõned uuringud näitavad insuliini taset olulist vähenemist tühja kõhuga ja 2 tundi pärast koormust 75 g glükoosi naistel SPE, mis kasutas metformiini. See vähendamine korrelatsioonis androgeeni taseme vähenemisega. Samuti tuleb märkida, et biguaniide kasutamine, mis normaliseerivad süsivesikute häired, põhjustavad sageli BMI vähenemist rasvumisega patsientidel ja sellel on positiivne mõju lipiidivahetusele.
Maailma kirjanduses on Tiazolidiindioni klassi kuuluvate ravimite kasutamise tulemused teatatud. Uuringud on näidanud, et ravi taustal troglitasoon (200-400 mg / päevas) paranenud insuliini tundlikkus naistel SPE, vähendas androgeeni taset. Kuid avastatud tsütotoksiline, selle ravimirühma hepatotoksiline toime piirab nende laialdase kasutamise võimalust. On otsida uusi ravimeid, selektiivselt mõjutada insuliini tundlikkust.
Hoolimata munasarjade hüperandrode raviks kasutatavate erinevate vahendite olulisest arsenalist, peaks selle patoloogia ravi olema keeruline ja järjekindel, mis võtab arvesse juhtivat patogeneetilist seost selles ravijärgus.
Naiste ravi SPE tuleks suunata mitte ainult selle haiguse tuvastatud sümptomite parandamisele, vaid ka võimalike tulevaste tüsistuste vältimiseks. On väga oluline, et androgeenide liigse sekretsiooni pärssida ja igakuise menstruatsiooni stabiilsuse esilekutsumiseks, mida manustatakse ratesti ravimite rakendamisel antandrogeensete omadustega (Diana-35).
Konservatiivse ravi ebaefektiivsuse korral aastas on võimalik tõsta töötluse kohta küsimuse - laparoskoopia kiilukujulise munasarjade resektsiooni või nende laserpaporisatsiooniga . Kirurgilise ravi tõhusus on kõrge (kuni 90-95% ovulatsiooni vähenemisest) ja esialgne patogeneetiline ravi suurendab saavutatud tulemuse stabiilsust.
Kirjandus:1. Ovsyannikova T.V., Demidova I.Yu., Glazkov O.I. Reproduktsioonprobleemid, 1998; 6: 5-8.
2. Ginzburg M.M., Khodtitsa G.S. Endokrinoloogiaprobleemid, 1997; 6: 40-2.
3. STARKOVA N.T. Kliiniline endokrinoloogia. Arstide juhend, 1991; 399.
4. Givens J.., Wiedeme E. B-endorfiini ja B-lipotrorororororororortase Hirsute naistel: korrelatsioon kehakaaluga. J Clin Endocr Metabol. 1980; 50: 975-81.
5. Aleem F.A., Mcintosh T. Polüküütilise munasarjaga naiste rühma plasmatasemed. Fertil ja steril. 1984; 42: 686-9.
6. DiDov I.I., Sunsov Yu.I., Kudryakov S.V. Endokrinoloogia probleemid. 1998; 6: 45-8.
7. Francis S., Greenspan, Forshman P.H. Põhi- ja kliiniline endokrinoloogia. 1987.
8. Akmayev IK Endokrinoloogia probleemid. 1990; 12-8.
9. Barbieri R.L., Hornstein M.D. Hüperinsulineemia ja munasarjade hüperandrogeenimine: Põhjus ja tagajärg. Endocrinool Metabl Clin North Am. 1988; 17: 685-97.
10. Barbieri R.L., MACRIS A., Ryan K.J. Insuliin stimuleerib androgeeni akumulatsiooni inkubeerimist inimese munasarjade stroma ja Theca. Ommakast Gynecol. 1984; 64: 73-80.
11. Barbieri R.L., Ryan K.j. Hüperandrogeensus, insuliiniresistentsus, akaenoosi nigricans: tavaline endokrinopaatia unikaalsete patofüsioloogiliste omadustega. Am J Ommaan Gynecol. 1983; 147: 90-103.
12. Barbieri R.L., Smith S., Ryan K.j. Hüperinsulseemia roll munasarjade hüperandrogeerimise patogeneesis. Fertiil ja steril. 1988; 50: 197-210.
13. Stuart C.A., Prints M.j., Peters E.J. Ommakast Gynecol. 1987; 69: 921-3.
14. JEN S.S.C. Krooniline anvalion Causeet perifeersete endokriinsete häirete abil. In: Yen S.S.C., Jaffe R.B. Reproduktiivse endokrinoloogia: füsioloogia, patofüsioloogia ja kliiniline juhtimine. Philadelphia: Saunders W.B. 1986; 462-87.
15. Moller D.E., Flier J.S. Insuliiniresseptori geeni muutmise tuvastamine insuliiniresistentsusega patsiendil, acanosis nigricans ja polütsüstilise munasarjade sündroomiga. N engl j med. 1988; 319: 1526-32.
16. Burgen G.A., Givens J.R. Insuliiniresistentsus ja hüperandrogeenimine: kliinilised sündroomid ja võimalikud mehhanismid. HEMISHERA KASUTAMINE CO, WASHINGTON, DC. 1988; 293-317.
17. Speroff L., klaas R. H. kliiniline günekoloogiline. Endokrinoloogia ja Infertiliti 5 tuh Ed. 1994.
18. Yoshimasa Y., Seino S., et al. Insuliiniresistentsuse diabeet, mis on tingitud punkti mucionist, mis prepessants insuliini pretseptori töötlemise./ teadus. 1988; 240: 784-9.
19. Dunaif A. endocrin. Rev., 18 (6): 1997; 12: 774-800.
Etinüülöstradiool + tsiproterontsetaat
Diana-35 (kaubanimi)
(SHERING AG)
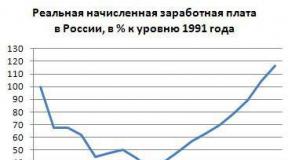
leiti, et see on nii väga üksikasjalik artikkel. Palju sõnu, aga ma loodan, et keegi aitab
R.a. ManusCherova, D.M., professor, E.I. HERCUZOVA, Sciences
"Hüperandrode"või" hüperandrodeemia"See mõiste tähistatakse meeste sugu hormoonide () suurenenud taset naistel. Hüperlandrode sündroom eeldab naiste välimust meeste jaoks iseloomulike Androgeeni märkete hagi all: juuste kasv näole ja kehale meestele; välimus naha akne; juuste väljalangemine nahapeale (alopeetsia); hääle vähenemine Timbre (Barfonoony) vähenemine; keha muutus (meheliinimine - male "fenotüüp), mille õlarihma laienemine ja reide ahenemine . Kõige sagedasem ja kõige varasem ilming hüperandrode on gariisismi - liigne juuste kasv naistel androgeenist sõltuvate tsoonide, mehelik kõrvale. Juuksekasv girsutismi täheldatakse kõhu keskjoone, nägu, rindkere, puusade sisepinda, seljaosa põhjaosas.
Naised hüperagratenia kuuluvad rühma suurenenud riskide tekkimist sünnituse tüsistuste tekkimist. Kõige sagedasem neist on ennekõndava vee ja tööjõu nõrkuse mõju.
Hürutismi ja hüperrtitoosi tuleks eristada - liigse juuste kasvu mis tahes kehaosades, kaasa arvatud need, kus juuste kasv ei sõltu androgeenist.
Hüperitikool võib olla nii kaasasündinud (pärilik autosomaalne domineeriv) ja omandas närvis anoreksia, porfüüria tulemusena ja esineb ka mõnede ravimite kasutamisel: fenotoin, tsüklosporiin, diazoksiid, anaboolsed steroidid jne.
Eristatakse kolm juuste kasvu etappi: kasvufaas (Anagen), üleminekuperiood (Catagen), puhkeetapp (telogen). Viimase etapi jooksul langevad juuksed välja.
Androgeenid mõjutavad juuste kasvu sõltuvalt nende tüübist ja lokaliseerimisest. Niisiis, edasi varajased etapid Seksuaalsus väikese androgeenide mõju all algab juuste kasv amorina ja häbemepiirkondades. Rohkem androgeenidega ilmub juuksed rinnale, kõhule ja näole ja väga kõrgel tasemel, karvade kasv pea on maha surutud ja nad ilmuvad otsaesise jaoks. Ja androgeenid ei mõjuta pulbri juuste, ripsmete ja kulmude kasvu.
Hirsutismi raskusastet määratakse sagedamini meelevaldselt ja hinnatakse valguse, mõõduka ja raskena. Üks objektiivseid meetodeid girsutismi raskusastme hindamiseks on Ferberlann ja Gallaelt (1961). Sellel skaalal on androgeenist sõltuvate juuste kasv hinnanguliselt vastavalt 9 kehapiirkonnale punktides 0 kuni 4. Kui punktide kogus on rohkem kui 8 - diagnoositud girsutismi.
Funktsionaalse hüperandrode (polütsüstiline munasarjade sündroom (PC), munasarjade tekamatoos jne) areneb girsutism järk-järgult, kaasas akne välimus, kehakaalu suurendamine ja ebaregulaarne menstruatsioon. Hirsutismi äkiline välimus kiiresti areneva viriliseerimisega märke võib näidata munasarjade või neerupealiste kasvajate androgeen-ärilistel kasvajatel.
Hüperandrode - meeste suguelundite hormoonide taseme suurendamine naistel veres põhjustab menstruaaltsükli rikkumise, liigse heitgaasi, viriliseerimise, viljatuse tõttu.
Hüperandrode korral häiritakse sageli kudede tundlikkust insuliini suhtes. Insuliini tase veres selles seisukorras suureneb ja suurendab suhkurtõbi riski.
Meeste suguelundite hormoonide arvu suurenemine võib olla seotud teiste endokriinsete organite patoloogiaga, nagu kilpnäärme või ajuripatsi. Neuroendokriinse sündroomiga (hüpotalamuse ja hüpofüüsi funktsiooni rikkumine) kaasneb haigus kehakaalu märkimisväärne kasv.
Peamised androgeenide hulka testosterooni, dihüdrotetosterooni (DGT), dehüdropiosterooni (DGEA) ja selle sulfaati, androtandiooni, D5 - androtandiooli, D4 -androtandetsiooni.
Testosteroon sünteesitakse kolesteroolist, kes siseneb inimkeha loomsete saadustega või sünteesides maksas ja toimetatakse välisse mitokondriamembraanile. Transport kolesterooli sisemise membraani mitokondria on gonadotropiini sõltuv protsess. Sisemembraanil muutub Mitokondria kolesterooliks pregeronalone (reaktsioon viiakse läbi tsütokroomi P450). Sujuva endoplasmaatilises reticulumis, järgides kahte genitaalhormoonide sünteesimist: D5 (peamiselt neerupealistes) ja D4 (peamiselt munasarjades), järgnevad reaktsioonid viiakse läbi. Bioloogiliselt ligipääsetav on tasuta ja seotud albumiini testosterooniga.
Naistes toodetakse testosterooni munasarjades ja neerupealistes näärmetes. Veres, 2% testosterooni ringleb vabas olekus 54% on seotud albumiiniga ja 44% GSCC-ga (globuliiniga seksuaalsete steroidide). GSPS-i tase suurendab östrogeeni ja madalamaid androgeenid, nii et mehed on 2 korda madalamad kui naistel.
GSSSi taseme vähendamine vereplasmas täheldatakse:
- rasvumine;
- androgeenide liigne moodustamine;
- ravi kortikosteroididega;
- hüpotüreoidism;
- akromegaalia.
GMS-i taseme suurendamine toimub siis, kui:
- ravi östrogeeniga;
- rasedus;
- hüpertüreoidism;
- maksatsirroos.
GSSS-ga seotud testosteroon täidab osa rakumembraani funktsioonidest, kuid ei suuda tungida sees. Tasuta testosterooni saab, pöörates 5A-DGT-d, mis ühendab retseptoriga, tungima sihtrakkudesse. Bioloogiliselt ligipääsetav on tasuta ja seotud albumiini testosterooni fraktsioonide summa.
Munasarjades ja neerupealistes toodetakse dehüdroepyondrosterooni (DHEA) poolt. Ta esmakordselt eraldati 1931. aastal ja on nõrk androgeen. Pärast ümberkujundamist testosterooni perifeersetes kudedes mõjutab see südame-veresoonkonna ja immuunsüsteemi.
Androstenadion, mis on testosterooni eelkäija, toodetakse munasarjades ja neerupealistes näärmetes. Androtedioni üleminek testosteroonile on pöörduv protsess.
Androgeenid täidavad selle mõju rakutasandil kõrge nefeine tuumaretseptorite kaudu. Ensüümi aromataasi androgeenide toimel muundatakse aromataasi östrogeenideks.
Tasuta testosteroon tungib sihtrakku ja seostatakse Androgeeni retseptoriga DNA X-kromosoomi puhul. Testosteroon või DGT, sõltuvalt 5a-reduktaasi aktiivsusest sihtrakkudes, suhelda androgeeni retseptoriga ja muutke selle konfiguratsiooni, mille tulemuseks muutus rakku südamikule edastatud retseptori dimeeride muutus ja suheldes sihtmärgiga DNA-ga.
Suur afiinsus androgeensete retseptorite jaoks on dehüdrototoroon, edasine testosteroon ja madala - neerupealiste androgeenide (DHEA, Androtandion).
Testosterooni mõju hulka kuuluvad: meeste seksuaalmärkide diferentseerimine; Sekundaarsete seksuaalmärkide tekkimine; Meeste suguelundite kasvu; Lobkovoy lahendamine; Juuksekasv amoriarvestuse depressioonides ja näole; kasvu hüpe puberteedi ajal; epifüüsi sulgemine; "Adam Apple'i" kasv; Häälühendite paksenemine; lihasmassi suurenemine, naha paksenemine; Rasuliste näärmete toimimine. Testosteroon mõjutab ka libiido ja tugevust, suurendab agressiooni.
Hüperandrode'iga märgitakse:
- juuste kasv näole ja kehale meessoost tüüpi;
- välimus naha akne;
- juuste väljalangemine pea (Alopeetsia);
- voice Timbre (Barfony) vähendamine;
- physiesi (meheliinimise) muutmine õlarihma laienemisega ja reide vähendamisega.
Hüpendrode arendab hüpotalamuse-hüpofüüsi süsteemi järgmisi haigusi:
- neuroendokriinse vahetamise sündroom rasvumise ja gonadotroopsete
düsfunktsioon; - kortikotropiin (incelko-cushing haigus);
- somatotropinoom (akromegaalia);
- hüperprolaktimeemia funktsionaalne ja prolaktiinia taustal;
- gonadotropinoomi, hormonaalselt mitteaktiivne adenoom hüpofüüsi "tühi" sündroom Türgi sadul;
- närviline anoreksia;
- rasvumine ja 2-tüüpi diabeet;
- insuliiniresistentsuse sündroomid (kaasa arvatud acanthosis nigricans tüüp (insuliiniretseptori geeni mutatsiooni) ja Lepraulismi);
- sekundaarne hüpothüreoidism.
Hüpendrode munasarjade ja neerupealiste vormide eraldada ja igaühel on kasvaja ja mitte-tuft vormid. SPK-s näitavad stromaalne hüperplaasia ja munasarjade tankimamatoosi munasarja geneesi neucholar või funktsionaalne hüperandrogeenimine, neerupealiste ajukoore (VDCN) kaasasündinud düsfunktsioon on neerupealise geneerimise funktsionaalne hüperandrogeenimine. Kasvajavorm hüperandrode põhjustab androgeeni tootvate munakasvajate või neerupealiste. Kortitoiduga on hääldatud hüperandrode.
Klassikaliste kaasasündinud düsfunktsiooni mitte-klassikaliste vormide käsitlemine AcTH (kortikotropiin) kõrgendatud taseme supressiooniga tuleb alustada. Selleks kasutavad nad deksametasooni. Samaväärsetes annustes on see rohkem väljendunud mõju võrreldes teiste glükokortikoidide ja vähemal määral viivituste vedelikuga. Deksametasooni ravimisel on vaja kontrollida kortisooli kontsentratsiooni. Kontroll toimub hommikul tundi.
VKN-ga patsientidel pärast deksametasooni piisavate annuste saamist taastatakse menstruaaltsükkel tavaliselt ja enamik muutub ovuraviks.
Ovulatsiooni puudumisel glükokortikoidravimite võtmise taustal VKN-i mitteklasse klassikalise vormiga või menstruatsioonitsükli luteini faasi puuduse korral on määratud klomifeenitraati (Klomid (EGIS, Höchst Marion Roussei, Saksamaa) Vastavalt üldtunnustatud skeemile 5 kuni 9 või 3 kuni 7 päeva jooksul menstruaaltsükli. Sarnaselt sarnasuse tõttu östrogeeni retseptorite rakkudes - sihtmärgid munasarjades, hüpofüüsides ja hüpotalamuse, ravimi klomifeen-tsitraat on kaks vastupidist mõju: Nõrk östrogeenne ja väljendunud anti-östrogeenne. Tänu asjaolule, et ravi efektiivsus täheldatakse, kui androgeeni süntees on surutud. Neerupealiste, ovulatsiooni stimulatsiooni tuleb läbi viia glükokortikoidide vastuvõtmise taustal.
Naistel esineb kombineeritud ravi taustal, ovulatsiooni esineb sageli ja rasedust tekib. Glükokortikoidi ravi lõpetamine pärast raseduse tekkimist võib põhjustada spontaanset raseduse katkemist või viljastatud muna väljatöötamise lõpetamist, seega tuleb ravi jätkata.
Gonadotroopsed ravimite LH ja FSH saab kasutada ovulatsiooni stimuleerimiseks mööda tavapärast skeemi, kuid tingimata glükokortikoidide vastuvõtmise taustal.
Kui teraapia taustal Clostilbytiga väidetava ovulatsiooni päevadel (13-14 päeva tsükli) päevadel säilitatakse kollase kehaetapi puudulikkus, seejärel võetakse kasutusele gonadotropiinid (LH ja FSH) sisaldavad ravimid: Profhaasia, Rasedad, pergsad jne suurtes annustes (5000-10 000 ed). Tuleb meeles pidada, et nende ravimite kasutamisel võib tekkida munasarjade hüperstimulatsiooni sündroom (Ksha).
Alla 30-aastased patsiendid, kellel on viljatuse ebatõhususe ebaefektiivne töötlemine rohkem kui 3 aastat ja näidatud polütsüstilise munasarja ultraheli mustri olemasolu kirurgia - laparoskoopilise juurdepääsu, demigraatorite või munasarjade elektrokarisimise kiilukujulise resektsiooni läbiviimine. Samal ajal jätkab glükokortikoidi ravi.
Madala ja mikrodoseeritud kombineeritud suukaudseid rasestumisvastaseid vahendeid (COC), millel on antidegeense toimega patsientide raviks VKN ja väljendunud garjusismi. Kõige tõhusam neist on: Diana-35, Zhanin, Yarina jne Need ravimid sisaldavad östrogeene ja gestageene nende koostises. Estrogeeni mõju all suurendatakse globuliintooteid, mis seonduvad sugu steroidid (GSSS) maksas maksas, millega kaasneb androgeeni seondumise parandamine. Selle tulemusena väheneb vaba androgeenide sisu, mis vähendab hirsutismi ilmingut. Nende ravimite antigonadotroopne toime pärsib gonadotropiinide moodustumist hüpofüüsi esiküljel ja hüpofüüsi gonadotroopse funktsiooni kõrge tase Androgeeni ringleva verega. Järelikult võib COC-i mõju viia gonadotropiinide kontsentratsiooni veelgi suurema vähenemiseni ja süvendanud kahjustatud menstruatsioonitsüklit. Sellega seoses ei tohiks Kok kasutamine VDKN'iga olla pikk.
Androgeeni tootvate munasarjade kasvajate ravi. Metastaaside tuvastamiseks uuritakse seda väikest vaagna ja näärmega. Kemoteraapia toimub kaugmetastaaside tuvastamisel. Pahaloomulise majanduskasvu ja levitamise märke puudumisel toodavad sellised reproduktiivedaga patsiendid ühepoolse adomektoomia ja naistel postmenopausijärgsel perioodil - emaka ekstirpeerimine koos lisadega. Pärast operatsiooni on vaja patsientide dünaamilist jälgimist hormoonide kontrollimise kontrolli, väikeste vaagna elundite ultraheli ultraheli. Metastaaside ja levitamiste puudumisel esineb pärast munasarjade kasvaja eemaldamist reproduktiivsuse patsientide täielikku taastumist: viiruratsiooni sümptomid kaovad, menstruaaltsükkel ja viljakus taastatakse. Kümneaastane ellujäämine sõltub kasvaja histoloogilistest omadustest ja suurusest ning on 60-90%.
Hormonaalselt aktiivsetes neerupealiste kasvajates näidatakse operatsiooni, kuna konservatiivset ravi puudub. Vastunäidustus on ainult protsessi väljendunud levitamine. Kardiovaskulaarse süsteemi kompeteerimisel lükatakse mädane tüsistused edasi. Sel juhul määras tunnistuse südame-, hüpotensiivsed, rahustid; Patsiendid diabeediga Mellitus enne operatsiooni tõlgitakse teraapia lihtsa insuliini fraktsioonide annused.
Operatiivne juurdepääs sõltub kasvaja suurusest ja lokaliseerimisest. Hiljuti toimub neerupealiste töötlus ravi laparoskoopilise meetodi abil. Pooperatiivse perioodi voolu sõltub kasvaja ja selle põhjustatud vahetushäirete hormonaalse aktiivsuse astmest ja liigist. Seetõttu peavad patsiendid olema ette nähtud konkreetse hormonaalse raviga.
Idiopaatilise girsutismi ravi. Antianterogeene kasutatakse idiopaatilise hirsutismi raviks - moodsate mikrodosteeritud ravimite raviks, mis sisaldavad östrogeeni ja gestageene nende koostises. Diana-35-l on nende ravimite seas suurim Antagandogeenne aktiivsus ja Zhanin, Valgevene, Yarina.
Lisaks kombineeritud suukaudsete rasestumisvastaste vahendite, androgeeni antagonistid on ette nähtud:
- spironolacton, rakulise taseme 5A-reduktaasi inhibeerimine ja vähendab testosterooni transformatsioonikiirust dehüdrootoosterooni;
- tsiproteron-atsetaat - progestiin, blokeerides androgeeni retseptoreid raku tasandil;
- tsimetidiin - histamiini retseptorite antagonist, mis blokeerivad androgeeni mõju raku tasandil;
- desogestrel, ketokonasool, metrodiin - GSSS-i taseme suurendamine, seondumise testosterooni ja muuta see bioloogiliselt mitteaktiivseks;
- flutamiid - nonteroidne antandrogeen, seonduvad androgeenide retseptoritega vähemal määral testosterooni sünteesi inhibeerivaks;
- finasteriidi - millel on antiandogendiline toime, inhibeerides 5A-reduktaasi aktiivsust ja ei mõjuta androgeeni retseptoreid;
- ketokanaasool - valdav steroidogenees;
- medroxyprogesteroon - gonadoliberini ja gonadotropiinide valdav sekretsioon, mis vähendab testosterooni ja östrogeeni sekretsiooni;
- gonadotropiini halastamise hormooni (GNVG) analoogid - toimimine funktsionaalne riik Munasarjad, ülekaalukad östrogeeni sekretsiooni, androgeen;
- glükokortikoidid.
Kuna kombineeritud suukaudsete rasestumisvastaste vahendite kasutamise mõju puudumisel vähendab flutamiidi eesmärk ammendumist, vähendab androstendiooni taset, dihüdrotestosterooni, LH ja FSH-d. COC ja Flutamiid võivad helistada järgmistele kõrvalmõjud: Kuiv nahk, loodete, söögiisu tõus, peavalu, pearinglus, piimanäärmete preseerimine, seksuaalse sisenemise vähenemine jne.
Ketokonasooli kasutamine on kaasas androstendiooni taseme, üldise ja vaba testosterooni märkimisväärne vähenemine vereseerumis. Androgeenide taseme vähendamine toob kaasa ammendumise nõrgenemise või kõrvaldamiseni.
Medroxyprogesteroon toimib globuliini, siduvate suguelundite hormoonide tasemel, vähendades viimaste sisu. Ravimi rakendamisel tähendades 95% patsientidest girsutismi vähenemist. Ravimi rakendamisel võib täheldada järgmist. kõrvalmõjud: Amenorröa, peavalu, turse, kehakaalu suurendamine, depressioon, maksafunktsiooni biokeemiliste näitajate muutus.
GNRG analoogide kasutamine põhjustab pöörlevat ravimite kastreerimist, millele kaasneb peenete nõrgenemine. Kuid nende kasutamine enam kui 6 kuu jooksul toob kaasa postmenopausiperioodi sümptomite arengut (loodete, soojuse tunne, tupe kuivaks, dispaway, osteoporoos). Ülaltoodud sümptomite väljatöötamine takistab ametisse nimetamist samaaegselt östrogeeni või COF-i analoogidega.
Suurendatud tasemega dehüdroepiandrosterooni või 17 glükokortikoidid on ette nähtud veres. Neil on deksametasooni suurim efektiivsus. Ravimi võtmise taustal patsientidel väheneb garjusismi ja muud hüperandrogeneria sümptomid kaovad. Deksametoosiga patsientide määramisel on võimalik hüpofüüsi ja neerupealiste süsteemi maha suruda, mistõttu on vaja kontrollida kortisooli taset veres.
Polütsüstilise munasarjade sündroomi ravi
PCOS-i ravis on vaja taastada ovulatoorne menstruatsioonitsükkel ja viljakus, kõrvaldada androgeenist sõltuva dermapaatia ilmingud; normaliseerida kehakaalu ja reguleerida metaboolseid häireid; Hoiatada hilinenud tüsistused Spka.
Insuliiniresistentsus (IR) ja selle potentsiaalse rasvumine on kõige olulisem patogeneetilise nurga seos PCOS-iga.
Kui rasvumine on rasvumine (BMI\u003e 25 kg / m2), peab PCOS-i ravi alustama kehakaalu vähenemisega. Preparaadid, mis vähendavad kehakaalu vähendavad preparaadid madala kalorsusega dieedi taustal, mis ei sisalda rohkem kui 25-30% rasva, 55-60% aeglastest süsivesikutest, 15% valkudest dieedi üldise kalorite sisaldusest. Soola kasutamine on piiratud. Dieediteraapia peab olema kombineeritud füüsilise aktiivsuse suurenemisega.
PCO-ga asuva keha liigne keha põhjustab hüperinsulaamia (GI) ja vähenemise perifeersete kudede tundlikkuse vähenemise insuliini (IR). Mitmetes uuringutes tehti siiski tõestati, et kui PCC-tundlikkus insuliini suhtes vähenes patsientidel mitte ainult kõrgendatud, vaid ka normaalse või vähendatud BMI-ga. Seega on PCC sõltumatu tegur, mis vähendab koe tundlikkust insuliini suhtes. Rasvumine täheldatud 50-70% patsientidel SPKA-l on sõltumatu negatiivne mõju, võimendus IR.
Biguanide on ette nähtud IR-i eemaldamiseks. Venemaal kasutatakse metformiini (Siofor, Firm Verlin Chemie, Saksamaa). Selle ravimi kasutamine BC vähendab glükoosi taset veres, pärsib glükoneogeneesi maksas ja suurendab perifeersete kudede tundlikkust insuliini. Metformiini kasutamise tulemusena väheneb keha mass, menstruatsioonitsükkel normaliseeritakse, testosterooni tase vere väheneb, kuid mitte ovulatsiooni ja rasedust ei täheldata alati.
Ovulatsiooni stimulatsioon - PCOS-i ravi teine \u200b\u200betapp. Kuid rasvumise ja spka ühendamisel peetakse ovulatsiooni stimuleerimist meditsiiniliseks veaks. Pärast organismi massi normaliseerimist ovulatsiooni stimulatsiooni stimuleerimiseks, klomifeene on ette nähtud. Täiendava stimulatsiooni ebatõhususe pärast 6-kuulist ravi võib patsienti pidada klomipõlmele. Seda täheldatakse 20-30% PCOS-i patsientidest. Sellisel juhul on FSH preparaadid ette nähtud: menogon - inimese menopausi gonadotropiin või sünteesitud rekombinantne FSH. GNVG analoogid on ette nähtud PCC-dega patsiendid ja LH kõrge tase. Nende ravimite mõju all esineb hüpofüüsi desessiseerimine, mis suurendab ovulatsiooni sagedust pärast FSH-ravimite kasutuselevõttu.
Kui konservatiivse ravi mõju puudub, kasutage ovulatsiooni kirurgilist stimulatsiooni. Laparoskoopiline juurdepääs tehakse kiilukujulise resektsiooni või nii munasarjade alandamise või toitlustamise teel. Endoskoopilise sekkumismeetodi kasutamine võimaldas oluliselt vähendada arengu sagedust. kleepumisprotsess Võrreldes laparotoomiaga.
SPKA Kirurgilise meetodi kasutamine Kasutamine järgmistel juhtudel:
- korduva düsfunktsionaalsete PCOS-i kombinatsiooniga emaka verejooks ja endomeetriumi hüperplaasia olenemata rasvumise olemasolust või puudumisest;
- naistel, kellel on normaalse kehakaalu märkimisväärne suurenemine LG tasemel vereplasmas;
- naised üle 35-aastased isegi rasvumisega. Sel juhul kohe pärast operatsiooni, intensiivne rasvumisravi viiakse läbi.
Järgmised tegurid võivad põhjustada menstruatsioonitsükli reguleerimise sageduse vähendamist ja raseduse tekkimist:
- kui 30-aastane naise võidmise kestus ja vanus;
- suured suurusega munasarjad, kellel on atreli folliikulite podcapslatoorne paigutus hüperplaatilise stroma ümber;
- hääldatud IR ja Ki sõltumata kehakaalust;
- menstruaaltsükli rikkumine Amenorröa tüübi järgi.
Hirsutismi ravi PCOs. Hirsutismi raviks kasutatakse samad ravimid idiopaatilise girsutismi raviks (vt eespool).
Tulenevalt asjaolust, et gariisismi põhjustab hüperagrateniast, kasutatakse ettevalmistusi raviks, vähendavad androgeenid, valdav androgeeni retseptorid; vähendatud androgeeni moodustumine; Valdav ensüümi süsteemid kaasatud sünteesi androgeeni tootmises (ekstrateeritud) testosterooni ja keerates selle DGT-sse.
Tänu asjaolule, et girsutismi ravi ravimeetodite abil on pikaajaline protsess, kohaldavad paljud naised erinevad Epilatsioon (elektriline, laser, keemiline, mehaaniline, fotopilaator).
SPC tüsistuste ravi
Et vältida metaboolsete häirete arendamise, on vaja vähendada kehakaalu. Et vältida endomeetriumi hüperplaasia arengut, on vaja läbi viia ultraheli kontrolli seisundi endomeetriumi ja vajadusel ravida progesterooni derivaadid. GE (endomeetriumi paksus rohkem kui 12 mm) juuresolekul määras hüsteroskoopia kontrolli all oleva limaskestade kraapimise ja teostada ka histoloogilist uurimist.
Lisaks viljakuse taastamisele tuleb PCC-ravi läbi viia, et parandada metaboolseid häireid, mis on 2. tüüpi diabeedi esinemise taust, varajane ateroskleroos, hüpertensioon, samuti suur risk hüperplaasia ja endomeetriumi adenokartsinoomi tekkimise oht.
Gyperandrogeneerimine naistel on suurenenud sisu Mees suguelundite hormoonid (testosteroon). Ta on eelkäija. Ümberkujundamist mõjutab ensüümi aromataas. Testosteroon toodetakse neerupealiste, munasarjade ja kleepuvate koe nõrgas põrandal. Igal neist tasanditel "jaotus" võib kaasa tuua erinevad tüübid Hüperandrode naistel.
Peamised hüperandrode liigid naistel
Praeguseks sõltuvalt päritolu põhjustest eraldatakse hüperandrode oma kahe peamise vormi. See on tõsi ja teised. Tõsi hulka munasarja ja neerupealiste hüperandrode. Päritolu tõttu võivad nad olla funktsionaalsed ja kasvaja.
Funktsionaalne tõeline hüperandrode naistel ja nende põhjuste põhjuseks:
- Munasarjade hüperandrode. See on seotud aromataasi ensüümi puudulikkusega, mis tagab testosterooni ümberkujundamise östrogeenides. Reeglina on see kaasasündinud defekt. Sageli on sageli nähtavad munasarjade geenide hüperandrogeenimine - kustutatud vormid (testosterooni tase võib olla normaalne, ei pruugi olla sklerotsüstiliste munasarjade ultraheli märke).
- Neerupealiste hüperandrode. Seotud ensüümi puudumisega, mis muutub testosterooni lähteaineteks. Hüperandrode sümptomid neerupealiste geenide sümptomid: mida iseloomustab testosterooni märkimisväärne kõrgendatud tase ja selle ilmnemise tõttu - girsutismi;
Muud vormid hõlmavad järgmist:
- Transport. Seotud globuliini puudusega, mis ühendab suguhormone (GSPG). See globuliin seondub ja takistab selle sattumise raku-sihtrakkudesse. GSPG toodetakse maksas, selle tasemed sõltuvad kilpnäärme tööst ja östrogeeni arvu tööst.
- Metaboolne hüperandrode. Seotud süsivesikute rikkumisega ja rasva vahetus. Alus on insuliiniresistentsus;
- Segagemeise Gyperandrogeneerimine. Kombinatsioon erinevad kuju ja hüperandrode sündroomi põhjused naistel;
- Yatrogeenne. Tekib erinevate ravimite tulemusena.

Hüpendrode põhilised sümptomid
Testosterooni kogueesmärgid: munasarjad, nahk, läga ja higi, samuti piimanäärmed, juuksed. Naiste hüperandrode juhtivad sümptomid pärast ilminguid:
- (muna valmimine ja väljumine), mis võib provotseerida viljatust ja põhjustada hüpertrota. Pikaajaline olemasolev hüpersaal on hormoonist sõltuvate elundite risk (emakas, munasarjad);
- Insuliiniresistentsus (kudede tundlikkus insuliini, mille tulemusena rakk ei imendu glükoosi ja jääb "näljane"). Viib teise tüübi suhkru-diabeedi väljatöötamiseni;
- Girsutism. Hüperandrogeenimise tunnused Sel juhul: juuste kasv androgeeni tsoonides (habemel, rinnal, eesmine kõhu seinal, käed, jalad, tagasi);
- Naha ilmingud (akne, seborröa, androgeeni sõltuv alopecia)
- Sclerokytous munasarjad: suurenenud mahuga, tiheda valguga ümbrisega, kuid paljude perifeerias asuvate valmistuslike folliikulitega. Loodud sümptomi "kaelakeed".
Hüpendrode diagnoosimine asetatakse vähemalt kahe ülaltoodud sümptomi põhjal.
Hüperandrode diagnoos naistel
Hüperandrode ravi naistel sõltub selle sündroomi põhjuse ja tüübi õige diagnoosimisest. Diagnostika areneb järgmistest sammudest:
- Kaebused suurenenud juuste kasv naistele naistele, akne välimus, viljatus, menstruaaltsükli kahjustus, sageli rasvumine;
- Anamnesis: sündroomide ilmingud hüperandrode langeb kokku puberteedi ja reproduktiivsusega;
- Andmete kontroll: rasvumine, girsutism, ülalkirjeldatud naha ilmingud;
- Hormonaalse eksami andmed: kõrgendatud vaba testosterooni tase, adrenokortikotroopne hormoon, dehüdroepistendinoon, prolaktiin;
- Andmed ultraheli: skleroküstiline munasarja, munasarjade mahu suurendamine või nende kasvajate, neerupealiste kasvajate mahu suurendamine;
- Globuliini taseme vähendamine suguhormoonide ühendamisel;
- Insuliini taseme tõus ja glükoositaluvuse häired.
Hüperandrode ravi naistel
Kas on võimalik hüperandrode ravida? Tõsi funktsionaalset hüperandrode ei kõvene, sest kaasasündinud ensüümi defektid. Ravi viiakse läbi, et kõrvaldada teatavad hüperandrode sümptomid naistel. Pärast ravi lõpetamist võib hüperandrode sümptomeid jätkata.
Hüperandrode ravi munasarjade geneeside naistel on kasutada steroidide (Diana 35, Ciproterotoon, Levonorgesteli) ja mittesteroidide (Flutomiini) tüübide antidrogeensete preparaadid.
Adreenneva genesi hüpenrandrogeenimise ravis kasutatakse deksametasooni.

Metaboolsete häiretega seotud hüperandrode ravi seisneb suurenenud füüsilise pingutuse ja vähendamise vahendite vähenemise, näiteks metformiini.
Prolaktiini taseme suurenemisega seotud naiste hüperandrogeenimissündroom nõuab vähendatud ravimite prolaciinide ametisse nimetamist (ALACTIN, BROMCRIENIN).
Tuumori genesi hüperandrogeenimise ravi seisneb nende vormide operatiivse eemaldamise korral munasarjadele, neerupealistele näärmetele, hüpofüüsidele.
Gyperandrogeneerimine tüdrukute varases eas on tavaliselt seotud neerupealiste verteal kasvaja Genesis sündroom vajab töötlus. Funktsionaalne hüperandrode lastel ilmub puberteedi perioodil.
Gyperandrogeneerimine raseduse ajal
Viljatus ei ole alati hüpendrogeenimise tagajärg. Siiski põhjustab östrogeeni hormoonide toodete rikkumist ja. Hüperandrode sündroomiga väheneb see hormoon. See sündroom näitab loodusliku progesterooni ravimite nimetamist, eriti esimeses trimestril, kui platsenta on "muutumas". Gyperandrogeneerimine raseduse ajal on mitte-ebaselge ja arusaamatuse riskitegur, metaboolse sündroomi arendamine lastel.
Hüpendrogeenimine on patoloogia, milles naiste hormonaalne taust läbib olulisi muudatusi. Liiga palju hormooni androgeeni areng, mida peetakse meestele. Naise kehas täidab see hormoon vajalike funktsioonide vastavust, kuid selle ülemäärane summa toob kaasa ebameeldivaid tagajärgi, mille ravi on vajalik.
Androgeene toodetakse naiste adipotsüüte, neerupealiste ja munasarjade. Need suguhormoonid mõjutavad otseselt naiste puberteediprotsessi, karvade kate välimust suguelundite ja kaenlaaluste valdkonnas. Androgeenid reguleerivad maksa, neerude tööd ja mõjutavad ka lihaskasvu ja reproduktiivsüsteemi. Nad on vaja küpsemad naised, nagu östrogeeni sünteesida, toetada piisav Libiido ja tugevdada luukangaid.
Mis on hüperandrode?
Naiste hüperandrogeenimine selle ilmingu ja tagajärgede foto
Hüperandrode on patoloogiline seisund, mis kõige sagedamini viib naiste amenorröa (menstruatsiooni täielik puudumine) ja viljatuse tõttu. Naiste munasarjade folliikulitega ümbritsevad rakukihid ja liigid androgeenid takistavad folliikulite kasvu, tulemusena tekib folliikulite atresia (folliikuleid ülevoolu). Lisaks, meeste hormoonide ülepingega, areneb munasarjakapsli fibroosi, mis toob kaasa polütsüskatsiooni (paljud munasarjade tsüstid).
Et assimege mehhanismi arendamise hüperandrode naistele, pidage meeles:
- Hüpotalamus on pea keskne reguleeriv osakond pea aju ajus vahetusprotsessid inimkehas; Vastutab endokriinsete ja seksuliste näärmete funktsionaalsuse eest. On kahe olulise süsteemi vaheline koostoime, näiteks närvis ja hormonaalsed;
- Pügafüüsi on peamine endokriinne raud, mis on aju barrel. Vastutab hüpotalamuse juhtimise hormonaalse vahetussüsteemi tegevuse eest;
- Keskse genessi rikkumised on aju regulatiivsed häired, mis ilmuvad hüpofüüsi ja hüpotalamuse ebaõige töö tõttu;
- Neerupealised on kaks väikest endokriinset näärmeid, mis asuvad neeru kohal. Need koosnevad kahest kihist - sisemise aju ja välise kortikaalse;
- Proov hüperandrode allika määratluse kohta deksametasooni kasutamisega - selle ravimi kasutuselevõtmisega määratakse kindlaks androgeenide tase veres naistel

Munasarjade lüüasaamine ja nendega tegelemine
Munasarjade geenide Gyperandrogeneerimine leitakse 4-5% naistest reprodutseerimise vanuses. Põhjuste mitmekesisus ei võimalda täpselt kindlaks määrata selle esinemise tingimuslikkust, kuid eraldatakse sündroomi patogeneesi peamine seos - need on peamised ja teisese regulatiivsed ebaõnnestumised hüpotalamite -gipofizar süsteemi töös. Need ebaõnnestumised põhjustavad LH tootmise ülemäärast stimuleerimist või toob kaasa gonadotroopsete hormoonide LG / FSH suurenenud suhte suurenemise.
Võrreldes suur või liigne kogus LH toob kaasa munasarjade sidekoe valgu membraani hüperplaasia, välise ja granuleeritud folliikirise kihi hüperplaasia. Sellepärast muutuvad munasarjade androgeenide arv, mis on nähtavad maskesiseerumise tunnused. Ebapiisav FSG põlvkond toob kaasa asjaolu, et folliikulid ei küpseta, naine algab annusel, nõudes ravi.

Põhjused on tugevad koormused ja meeste hormoonide liig
Teadlased - Medika soovitab, et Emeries munasarjade hüperandrode:
- suhteline või tingimusteta liigne LG, mis tuleneb adenogipofoni või hüpotalamuse ebaõige toimimise tõttu;
- meeste meeste suguelundite steroidhormoonide liigne süntees neerupealiste ajukoore prepabertaalse perioodi jooksul;
- Üleliigse rasva kogunemine vertikaalses vanuses. Arvatakse, et rasvumine on domineeriv riskitegur, kuna mõlemad androgeenid konverteeritakse östrogeenides;
- insuliiniresistentsus ja hüperinsulseemia;
- steroidide halvenenud geneerimise tõttu naiste munasarjades. Osa patsientidest on intensiivne tootmine 1755-hüdroksülaasi, ensüümi konverteeriva 17-hüdroksüpneenolooni DHEA ja 17-hüdroksüprogesteroon Androstendiooni steroidhormooni;
- primaarne hüpoterioos
Polütsüstilised munasarjad naistel võivad esineda neerupealiste mitte-klassikalise kaasasündinud hüperplaasiaga.
Muudel põhjustel võib hüperandrode klassifitseerida androgektiivsetele neoplasmetele munasarjadele (nõudes kirurgilist ravi), hüpenpekosoosi ja Ledizoomi.

Sümptomid on liigne põllumajandus
Sümptomid hüperandrode võib olla peamine:
- aktiivne levik naise jäsemete ja muude kehaosade (kõht, piimanäärmete). Juuksed hakkavad kasvama põske- - seda tüüpi ammendumist nimetatakse girsutismi;
- slükeerib pea (Alopeetsia);
- puudused ilmuvad näol, akne, akne, koorimise ja erinevate põletikide kujul (ravi kosmeetikis ei anna tulemusi);
- osteoporoosi areneb, täheldatakse lihaste atroofiat;
Naiste hüperandrode sündroomil on sekundaarsed ilmingud (sõltuvalt haiguse etapist ja põhjustest):
- vere glükoosi (teise diabeedi) parandamine;
- terav kogum kaal (rasvumine töödeldava);
- suguelundite moodustumine naistel vahepealse tüübi järgi;
- naine ei ole kunagi menstruatsioonid või tsükkel jagatud märkimisväärse intervalliga;
- infertity või talumatu lootele, kui on olemas hüperandrode raseduse ajal (loote ohutu tööriistade jaoks, vajab naise keha teatud koguses naiste hormoonid ja hüperandrode ajal praktiliselt toodetud);
- arteriaalse hüpertensiooni rünnakud
Naised hüperandogeenia on sageli külm, kalduvad depressiivseid riike, kiire väsimus. Patsiendi vanus ei ole oluline - hüperandrogeneemia võib olla haige absoluutselt igas vanuses eluajal, alustades sünnist.

Diagnostika seisneb arsti uurimisel, tuvastades haiguse põhjused
Naise uurimise alguses püüab arst eelkõige välja jätta kaasasolevate haiguste:, maksahaiguste, soo diferentseerumise, cushing sündroom, kasvaja androgenktsiooni moodustamine neerupealistel.
Hüperandrode diagnoos naistel kliinilises laboris:
- Peamise hormonaalse taseme määramine. Tuleb välja, milline on prolaktiini, vaba ja üldise testosterooni, dehüdropesiandrosteroonsulfaadi arv, androtandioon ja FSH tase vereplasmas. Materjali tara tehakse hommikul tühja kõhuga. Hormonaalse tausta püsiva muutuse tõttu tehti hüperandrogeeniga patsient proovi kolm korda, 30-minutilise protseduuride vaheliste lünkade vahel, seejärel segatakse kõik kolm vereosa. Dehüdropihystosteroon Sulfaat, mis on suurem kui 800 ug%, näitab androgeeni seatud neerupealise kasvaja olemasolu;
- Määratakse ketosteroidide kogus uriinis;
- Võtke marker xg määratlusele (juhul, kui on hüperandrode märke, kuid androgeeni peamine tase jääb normaalseks).
Uuring on instrumentaalne: hüperandrode kahtlusega patsient on suunatud MRI-le, CT-le, intrafinaalsele ultrahelile (kasvajakujunduste visualiseerimiseks).

Ravi toodetakse erinevad ravimid Sõltuvalt naise kujust ja soovidest
Sõltub naise haigete hüperagratenia isiklikest soovedest:
- kui lapsed eeldatakse tulevikus, teostab ravi clomiphene;
- kui naine ei kavatse viljakaid funktsioone taastada, määras ta ravi hormoonidega (suukaudsed rasestumisvastased vahendid). Suure LH-ga (juba kahe kuu jooksul pärast narkootikumide vastuvõtmist) tagastatakse Androtandion ja testosterooni tase normaalsesse;
- kui rasestumisvastased vahendid on naisele rasestumisvastased, on see ette nähtud spironolanktoni raviks. Ravi kulg on kuus kuud.
- munasarjade kasvajad eemaldatakse töökorras

95% neerupealiste vorm on kaasasündinud, selle ravi peaks olema täpne ja kvaliteetne
Neerupealiste hüperandrode on sagedamini kaasasündinud. Masque sümptomid sel juhul ilmneb varakult. Esimesed naisiperioodid ilmuvad väga hilja ja tulevikus saavad nad või muutuvad väga harvadeks või peatuvad üldse. Neerupealiste hüperandrode puhul on kõigil patsientidel rikas akne rikas selja- ja rindkere, kohaliku naha pigmentatsiooni.
Naistel on rinnanäärme hüpoplaasia, joonisel kujuneb meessoost tüüpi (vaagna-kitsas, õlavarras). Neerupealise hüperandrode puhul on naise kliitor mõnevõrra hüpertroofia, emakas muutub väiksemaks, kuid samal ajal jäävad munasarjad tavaliseks.
Naiste hüperandrode diagnoosimine ja ravi nõuab maksimaalset täpsust. Hüperandrode neerupealise genesi, glükokortikoidi ravi on soovitatav ravimpreparaadidHormonaalse taseme säilitamiseks normis.