Millest piimhape koosneb? Piimhappe keemilised ja füüsikalised omadused piimhappe keemiline viide
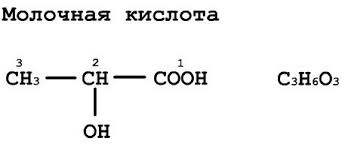
Piimhape (laktaat)- α-hüdroksüpropioonhape (2-hüdroksüpropaanhape).
- t pl 25-26 ° C optiliselt aktiivne (+) - või (-) - vorm.
- t pl 18 ° C ratseemiline vorm.
- Keemiline valem: CH 3 CH (OH) COOH
- Ratseemiline valem: C3H6O3
Piimhape tekib suhkrute piimhappekäärimisel, eelkõige hapupiimas, veini ja õlle käärimisel. Seda kasutatakse nii keemilises kui ka Toidutööstus- säilitusainena. Inimkehas tekib glükoosi lagunemisel piimhape (laktaat).
Niisiis, kas piimhappel ja laktaadil on vahet? Ei. Orgaanilises keemias nimetatakse piimhapet sagedamini, biokeemias - laktaadiks.
Laktaati ümbritseb ilmselt kõige rohkem erinevaid müüte, millest enamik ei vasta tegelikkusele. Ja kuigi vene keeles on laktaadi kohta piisavalt usaldusväärseid materjale, jätkavad arvukad harrastussportlased (ja mõned professionaalid) kangekaelselt eelmise sajandi müütide uskumist ja kordamist.
Võtame lühidalt ja kokkuvõtlikult kokku peamised faktid laktaadi kohta.
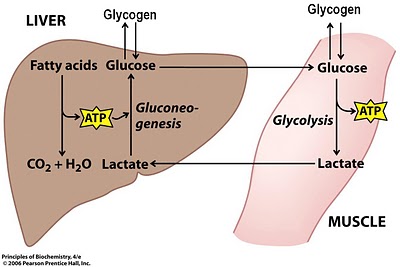
Laktaat tekib alati kehas energia tootmise käigus.
Peamine rakkude energiavarustuse tee on glükoosi lagunemine. Glükoosi molekul läbib 10 järjestikust reaktsiooni, et toota püruvaati protsessis, mida nimetatakse glükolüüsiks. Lisaks oksüdeerub üks osa püruvaadist osaliselt ja muundatakse süsinikdioksiidiks ja veeks. Teine osa muundatakse ensüümi laktaatdehüdrogenaasi kontrolli all laktaadiks.
See reaktsioon on pöörduv.
Osa laktaadist kasutatakse energia sünteesiks.
15–20 protsenti kogu laktaadist muundatakse glükoneogeneesi käigus glükogeeniks.
Laktaat on universaalne energiakandja.
Suure energiatootmise tingimustes anaeroobses režiimis on laktaat energiakandja nendest kohtadest, kus suurenenud happesuse tõttu ei ole võimalik energiat muundada, kohtadesse, kus seda saab energiaks muuta (süda, hingamislihased, aeglaselt tõmblused lihaskiud, muud lihasrühmad).
Laktaaditaseme tõus ei ole tingitud hapnikupuudusest.
Loomkatsed näitavad, et isoleeritud lihaste rakusisene hapnikupuudus ei näita mitokondriaalse hingamisahela aktiivsust isegi maksimaalse treeningu ajal. Meie lihastes on alati piisavalt hapnikku.
Laktaat on anaeroobse glükolüüsi koormuse indikaator.
Iga kord, kui moodustub glükolüüsi käigus glükoosi metabolismi lõpp-produkt püruvaat, tekib laktaat. Laktaat koguneb lihtsalt seetõttu, et energia muundumise kiirus anaeroobse ja aeroobse treeningu ajal on erinev.
Mida suurem on töö intensiivsus, seda rohkem laktaati toodetakse.
Vere laktaadisisaldus on tihedalt seotud treeningu intensiivsusega. Laktaat koguneb anaeroobse ja aeroobse treeningu energia muundamise kiiruse erinevuse tõttu. Energia muundamise kiirus anaeroobse energiavahetuse korral on kiirem kui aeroobse ainevahetuse korral.
Laktaat ei tekita happelisust, see on sellega kaasas.
Energiat tootdes toodame samaaegselt happelisust. Energiareaktsioonid meie kehas toimuvad elektronide kui energiakandjate osalusel. Glükolüüsi saadused on laktaat ja vesinikprooton H +. Vesinikuioonide (H +) aktiivsuse (kontsentratsiooni) mõõt lahuses väljendab selle happesust.
Laktaat võtab reaktsiooni läbiviimiseks vaid ajutiselt happelise aine (H +), seejärel suunab selle tagasi neutraalsesse keskkonda.
90% laktaadist kasutab keha ära esimese tunni jooksul pärast treeningut.
60% laktaadist organismis on täielikult oksüdeerunud CO2-ks ja veeks. Umbes 20% muundatakse glükoneogeneesi protsessis glükogeeniks, osa kasutatakse aminohapete moodustamiseks. Ainult väike osa (alla 5%) laktaadist eritub higi ja uriiniga.
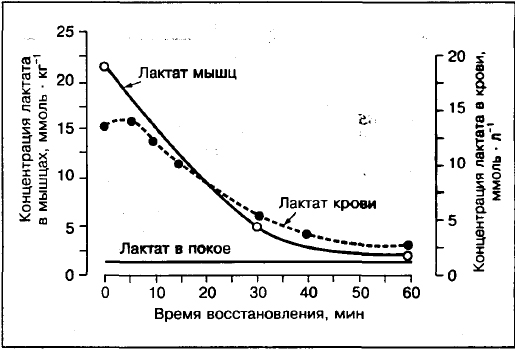
Veres sisalduv laktaat ei kajasta süstemaatiliselt laktaadi olemasolu lihastes.
Laktaadi kontsentratsiooni võrdlus lihastes ja veres näitab, et kui pingutus ületab 75-80% VO2max, siis on laktaadi kontsentratsioon lihastes (reie esiosa lihaste biopsia) kõrgem kui veres. Erinevalt mõõduka intensiivsusega tegevustest 30%, 50%, 70% VO2max, kus laktaadi kontsentratsioon arteriaalne veri kõrgem kui lihastes.
Laktaat ei põhjusta lihasvalu ega krampe.
Päev pärast intensiivset treeningut lihaste valulikkus on tingitud lihaste kahjustusest ja koepõletikust, mis tekib pärast treeningut. Enamik lihaskrampe on põhjustatud lihaste närviretseptoritest, mis erutuvad lihaste väsimusega.
Põhineb saidi cmtscience.com materjalidel (2016).
Hüdroksühapped (alkoholhapped) on karboksüülhapete derivaadid, mis sisaldavad ühte, kahte või enamat hüdroksüülrühma karboksüülrühmaga seotud radikaalis.
Sõltuvalt karboksüülrühmade arvust jagatakse hüdroksühapped ühealuselisteks, kahealuselisteks jne; olenevalt hüdroksüülrühmade koguarvust jagunevad oksühapped ühe- või mitmehüdroksüülseteks.
Vastavalt radikaali olemusele on hüdroksühapped küllastunud ja küllastumata, atsüklilised, tsüklilised või aromaatsed.
Hüdroksühapetes leidub järgmist tüüpi isomeeria:
struktuurne(radikaalahela isomeeria, karboksüüli ja hüdroksüüli vastastikuse positsiooni isomeeria);
optiline(spekulaarne), asümmeetriliste süsinikuaatomite olemasolu tõttu.
Oksühapped on nimetatud happe järgi, millele on lisatud "hüdroksü" või "dioksiid" jne. Laialdaselt kasutatakse ka triviaalset nomenklatuuri.
NO – CH2 –COOH
glükool (oksüäädikhape)
piimhape (α-hüdroksüpropioonhape)
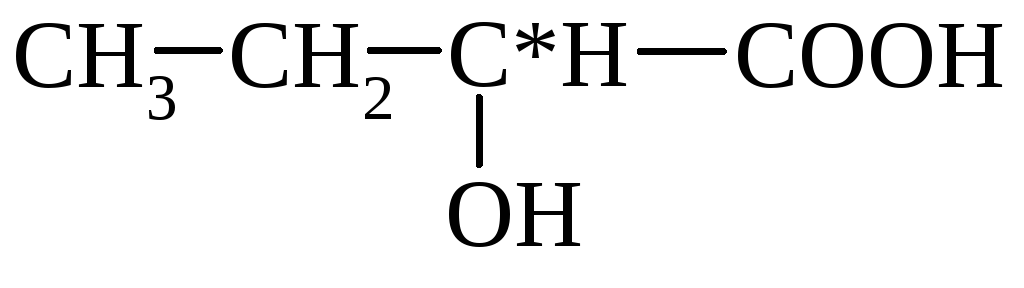
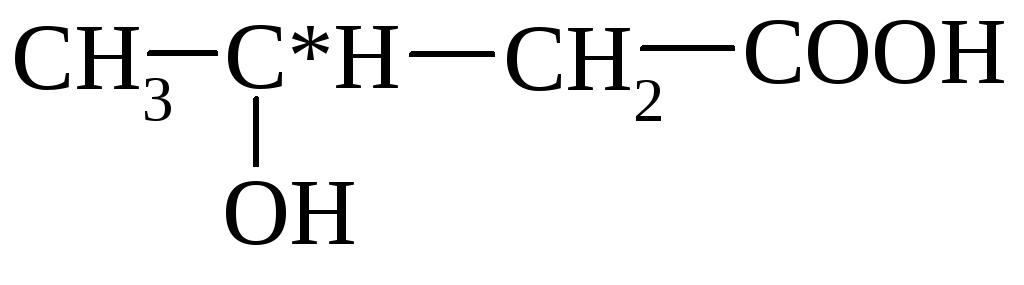
α-hüdroksübutüürhape β-hüdroksüvõihape
(2-hüdroksübutaan) (3-hüdroksübutaan)
Füüsikalised omadused. Madalamad hüdroksühapped on enamasti paksud siirupilised ained. Oksühapped segunevad veega mis tahes vahekorras ja molekulmassi suurenemisega lahustuvus väheneb.
Keemilised omadused.
1. Happelised omadused - hüdroksühapped annavad kõik karboksüülile iseloomulikud reaktsioonid: soolade, estrite, amiidide, halogeniidide jne teke. Hüdroksühapped on tugevamad elektrolüüdid kui neile vastavad karboksüülhapped (hüdroksüülrühma efekt).
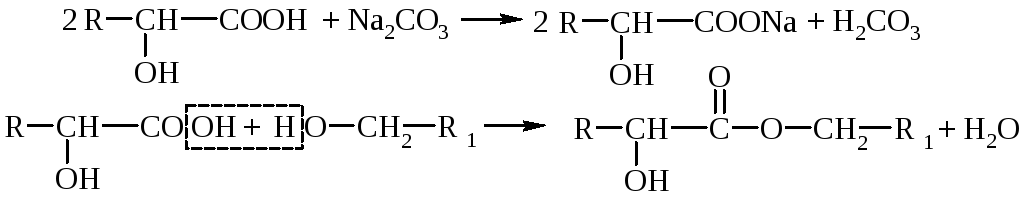
2. Alkoholiomadused - hüdroksürühma vesiniku asendamise reaktsioonid, eetrite ja estrite moodustumine, –OH asendamine halogeeniga, molekulisisene dehüdratsioon, oksüdatsioon.
kloroäädikhape glükool glüoksaalhape
hape hape hape
a) HO – CH 2 –COOH + CH 3 OH HO – CH 2 –CO – O – CH 3 + H 2 O
glükoolhappe ja metüülalkoholi ester
b) HO – CH 2 –COOH + 2CH 3 OHCH 3 –O – CH 2 – COOCH 3 + 2H 2 O
glükoolmetüülmetüüleeter
happeline alkohol metoksüäädikhape
(täielik saade)
3. Hüdroksühapete ja kuumutamise suhe – kuumutamisel eralduvad α-hüdroksühapped veest, moodustades tsüklilise estri, mille moodustavad kaks α-hüdroksühappe molekuli:
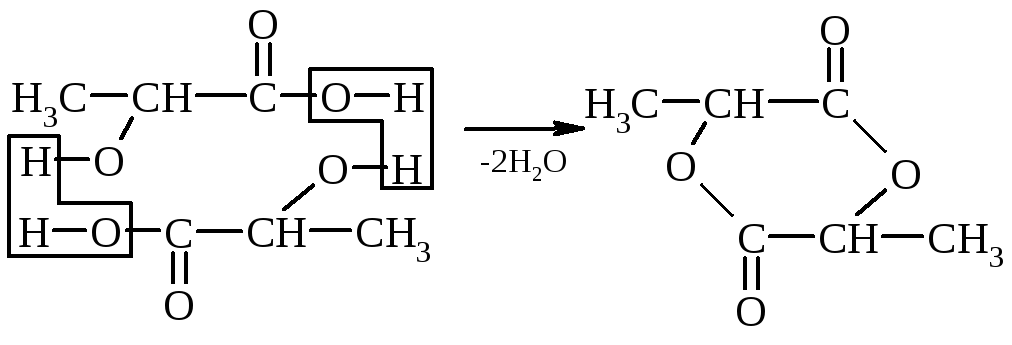
α-hüdroksüpropioonhappe laktiid
β-hüdroksühapped kaotavad samadel tingimustel kergesti vett, moodustades küllastumata happeid.
HO – CH2 –CH2 –COOH  CH 2 = CH – COOH
CH 2 = CH – COOH
β-hüdroksüpropioonakrüülhape
γ-hüdroksühapped võivad kaotada ka veemolekuli koos molekulisiseste estrite – laktoonide moodustumisega.
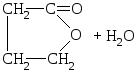
HO – CH2 –CH2 –CH2 –COOH
y-hüdroksüvõihape
y-butürolaktoon
Mõned hüdroksühapped on saadud looduslikest toodetest. Niisiis saadakse piimhapet suhkrurikaste ainete piimhappekääritamisel. Sünteetilised tootmismeetodid põhinevad järgmistel reaktsioonidel:
1) Cl – СН 2 –СООН + НОН 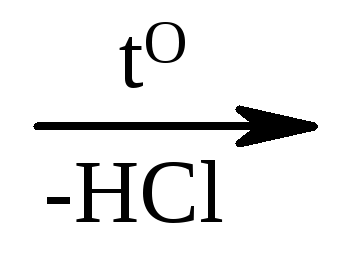 HO – CH2 –COOH;
HO – CH2 –COOH;
monokloroäädikhappe glükool
happeline hape
2) CH 2 = CH – COOH + NOH 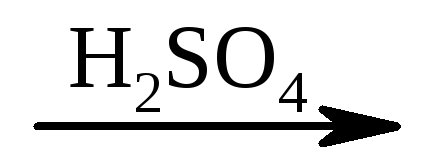 HO – CH2 –CH2 –COOH.
HO – CH2 –CH2 –COOH.
akrüülhape β-hüdroksüpropioonhape
Hüdroksühapete esindajad.
Glükool (hüdroksüäädikhape) on kristalne aine, mida leidub valmimata puuviljades, peedimahlas, naeris ja teistes taimedes. Tööstuses saadakse see oksaalhappe redutseerimisel. Seda kasutatakse värvimiseks (kalicotrükk).
Piimhape (α-hüdroksüpropioonhape) on paks vedel või madala sulamistemperatuuriga kristalne mass. Piimhape tekib suhkrute piimhappekäärimise käigus piimhappebakterite toimel. Sisaldub fermenteeritud piimatoodetes, hapukapsas, silos. Seda kasutatakse peitsvärvimisel, nahatootmisel, meditsiinis.
Liha ja piimhapet leidub loomade lihasmahlas ja lihaekstraktides.
Diatoomiline glütserhape osaleb taimede ja loomade eluprotsessides.
C-vitamiin (C-vitamiin) on kristalne aine, mis sisaldub värsked puuviljad, sidrunid, mustad sõstrad, sisse värsked köögiviljad- kapsas, oad. C-vitamiini sünteesitakse sorbitooli mitmehüdroksüülse alkoholi oksüdeerimisel.
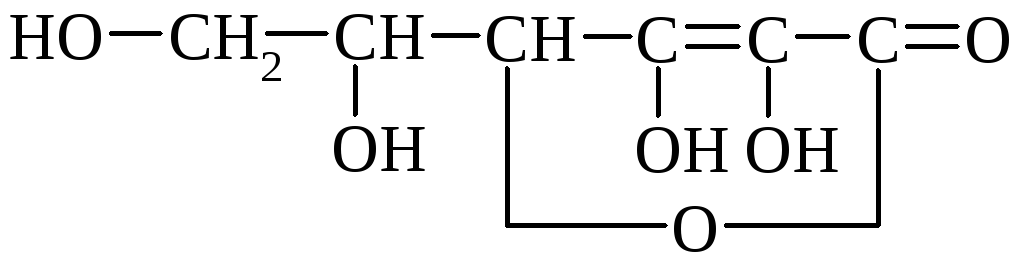 α-askorbiinhape
α-askorbiinhape
Askorbiinhape laguneb kergesti õhuhapniku toimel, eriti kuumutamisel
Atsükliline kaks-ja kolmealuselised hüdroksühapped.
Apple (hüdroksü-merevaik)hape (HOOC – CHOH – CH 2 –COOH) on vees hästi lahustuv kristalne aine; kasutatakse meditsiinis, sisaldub valmimata pihlakas, lodjapuus, rabarberis, viinamarjamahlas, veinis.
Vein (viin-, dioksümerevaik)happel (HOOC– * CHOH– * CHOH – COOH) on 2 asümmeetrilist süsinikuaatomit ja seetõttu on sellel 4 optilist isomeeri. Moodustab happelisi kaaliumisooli, mis lahustuvad vees halvasti ja sadestuvad. Veinis (viinakivis) võib täheldada soolakristalle. Segatud kaaliumi-naatriumi soola nimetatakse Rochelle'i soolaks. Viinhappe sooli nimetatakse tartraatideks.
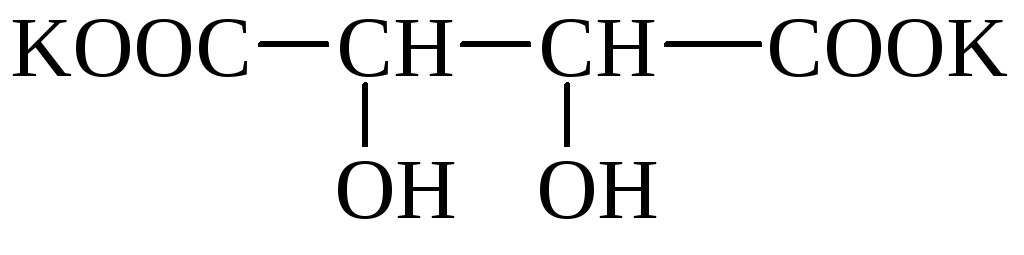
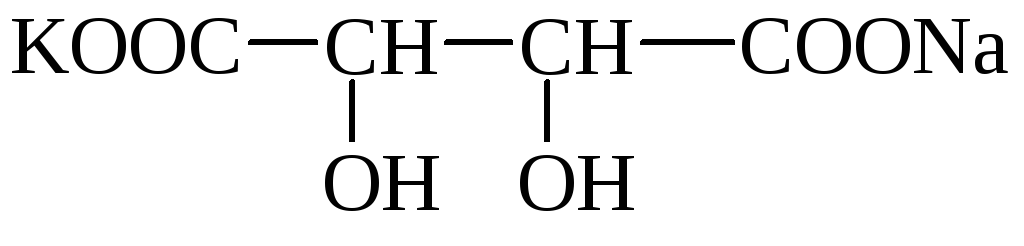
Tatar Rochelle sool
Viinhape on levinud taimedes (pihlakas, viinamarjad jne).
Sidrunihape
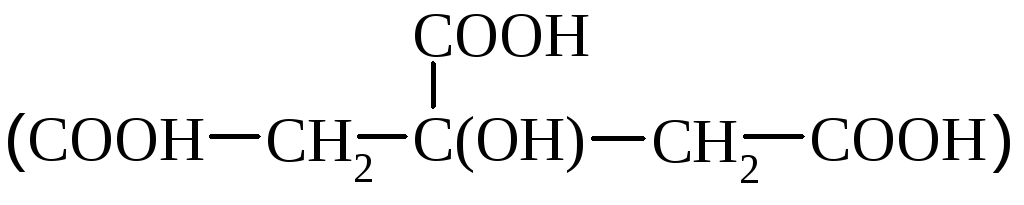 leidub tsitrusviljades. Tööstuses saadakse seda sidruni viljadest, suhkrute oksüdeerimisel hallitusseentega kuuseokaste töötlemisel.
leidub tsitrusviljades. Tööstuses saadakse seda sidruni viljadest, suhkrute oksüdeerimisel hallitusseentega kuuseokaste töötlemisel.
Sidrunhape on bioloogiliselt oluline ühend, mis osaleb ainevahetuses. Seda kasutatakse meditsiinis, toiduainetes, tekstiilitööstuses värvainete lisandina.
Tsüklilised ühealuselised mitmehüdroksüülhapped on osa sapphapetest ja teistest füsioloogiliselt olulistest ühenditest; näiteks auksiin kiirendab taimede kasvu.
Aromaatsed hüdroksühapped jagunevad fenoolhapeteks ja rasv-aromaatseteks hapeteks, mis sisaldavad külgahelas hüdroksüülrühma.
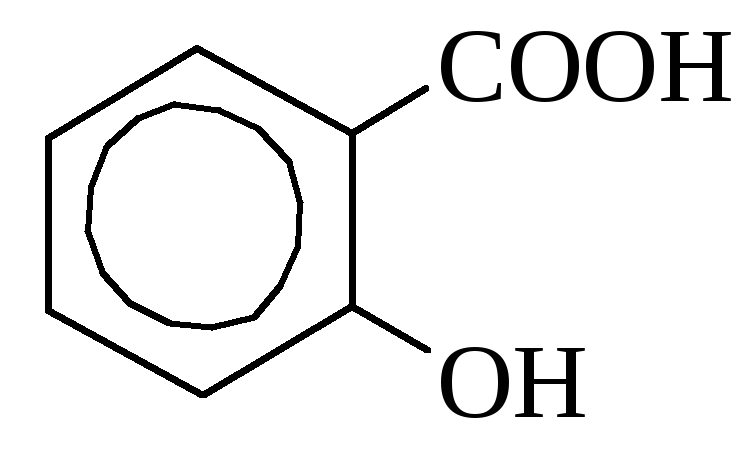
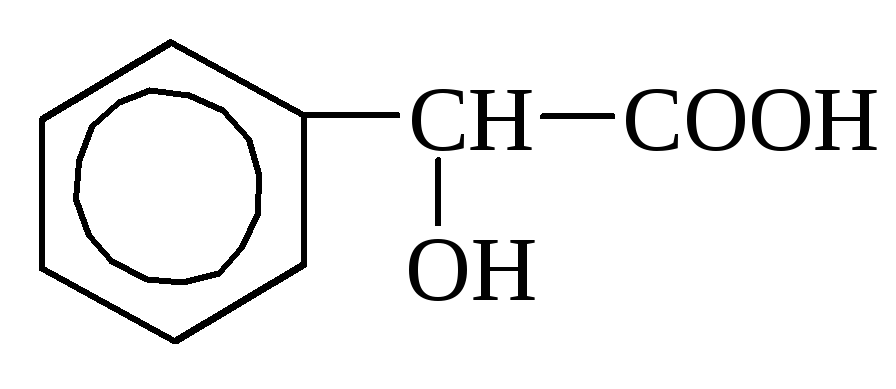
o-hüdroksübensoe mandelhape
(salitsüülhape
Salitsüülhape leidub mõnes taimes vabal kujul (saialill), kuid sagedamini estritena. Tööstuses saadakse seda naatriumfenolaadi kuumutamisel süsinikdioksiidiga. Seda kasutatakse desinfektsioonivahendina ja värvainete sünteesil. Ravimitena kasutatakse palju salitsüülhappe derivaate (aspiriin, salool).
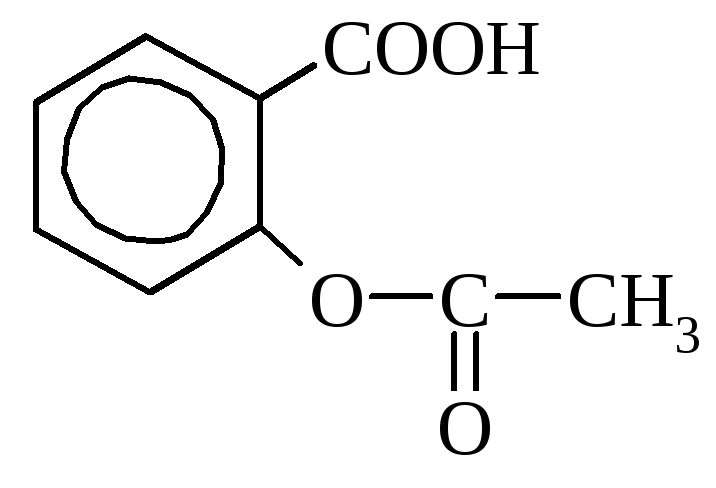
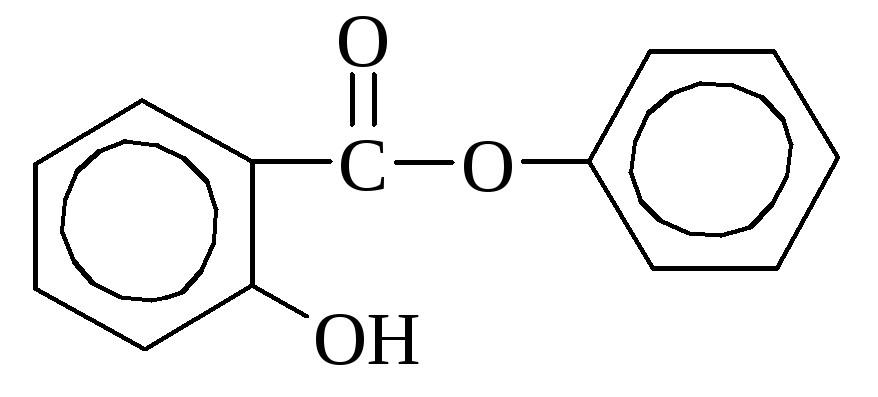
aspiriini salool (fenüüleeter
(atsetüülsalitsüülhape) salitsüülhape)
Gallushape (3,4,5-trioksübensoehape).
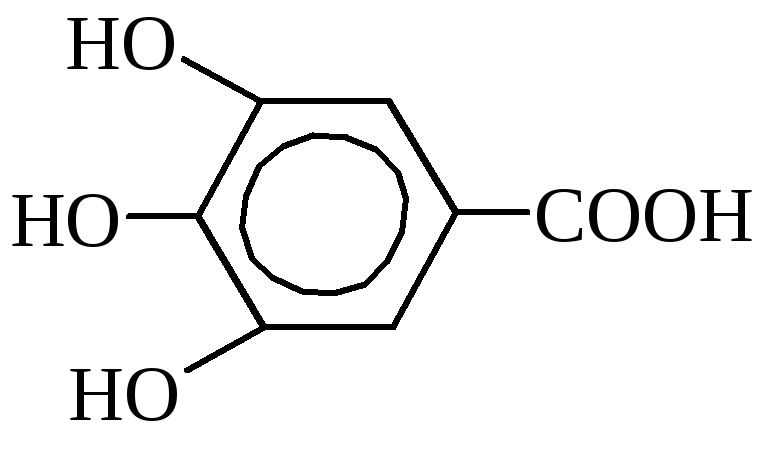
Sisaldub teelehtedes, tammekoores, granaatõunapuus. Tööstuses saadakse seda tanniinist lahjendatud hapetega keetmisel. Seda kasutatakse tindi valmistamiseks, fotograafias, meditsiinis antiseptikuna. Gallushapet ja selle derivaate kasutatakse laialdaselt paljude toiduainete (rasvad, kõrgekvaliteedilised seebid, piimatooted) säilitusainetena, neil on parkimisomadused ja neil on teatud tähtsus naha tootmisel ja peitsvärvimisel.
Mandelhape viitab rasv-aromaatsetele hapetele (C 6 H 5 –CH (OH) –COOH), sisaldub amügdaliinis, sinepis, leedris jm.
Tanniinid on sageli mitmehüdroksüülsete fenoolide derivaadid. Neid leidub taimedes ja neid saadakse koore, puidu, lehtede, juurte, viljade või kasvu (sapikeste) ekstraktidest.
Tanniinid on kõige olulisemad tanniinid. See on segu erinevatest keemilised ühendid, millest peamised on gallus- ja digaalhapete ning glükoosi ehk mitmehüdroksüülsete alkoholide estrid.
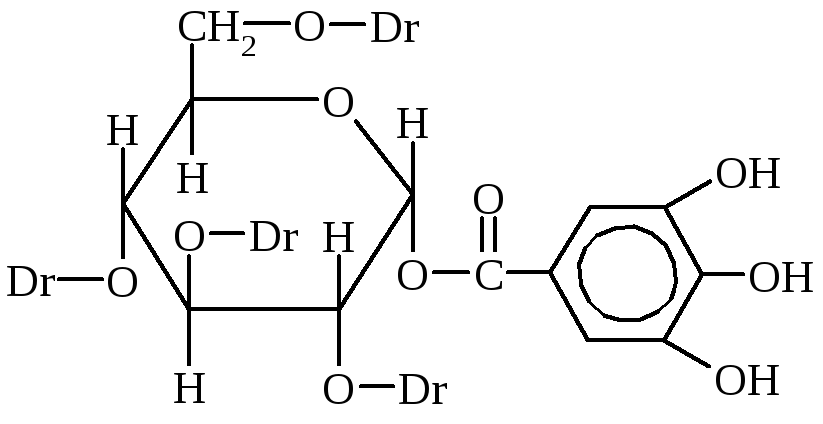
Dg-digalliinhape
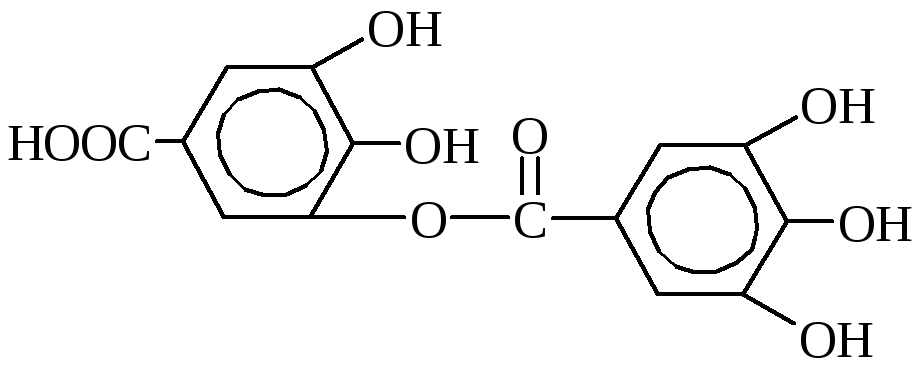
m-digalliinhape
Tanniinil on fenoolide ja estrite omadused. Raudkloriidi lahusega moodustab see musta värvi keerulise ühendi. Tanniine kasutatakse laialdaselt parkimisekstraktidena, peitsainetena puuvillase kanga värvimisel, sideainetena meditsiinis (neil on bakteritsiidsed, hemostaatilised omadused) ja säilitusainetena.
Lipiidide hulka kuuluvad orgaanilised ained, millest paljud on suure molekulmassiga rasvhapete ja mitmehüdroksüülsete alkoholide estrid, nagu rasvad, fosfatiidid, vahad, steroidid, suure molekulmassiga rasvhapped jne.
Lipiide leidub peamiselt taimede seemnetes, pähklituumades ja loomsetes organismides - rasv- ja närvikudedes, eriti loomade ja inimeste ajus.
Looduslikud rasvad on glütserooli ja kõrgemate karboksüülhapete kolmehüdroksüülsete alkoholiestrite segud, s.o. nende hapete glütseriidide segud.
O 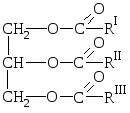 Üldine rasvavalem:
Üldine rasvavalem:
kus R I R II R III on normaalse struktuuriga kõrgemate rasvhapete süsivesinikradikaalid paarisarvu süsinikuaatomitega. Rasvade koostis võib sisaldada nii küllastunud kui ka küllastumata hapete jääke.
Küllastunud happed:
С 15 H 31 COOH - palmitiin;
C17H35COOH - steariin;
C 3 H 7 COOH - õli (sisaldub võis) jne.
Küllastumata happed:
C17H33COOH - oleiinhape;
С 17 Н 31 COOH - linoolhape;
C 17 H 29 COOH - linoleen jne.
Rasvad saadakse looduslikest loomse ja taimse päritoluga allikatest.
Füüsikalised omadused rasvad on tingitud happelisest koostisest. Peamiselt küllastunud hapete jääke sisaldavad rasvad on tahked või õlised ained (lambaliha, veiserasv jne) Rasvad, mis sisaldavad peamiselt küllastumata hapete jääke, on toatemperatuuril vedela konsistentsiga ja neid nimetatakse õlideks. Rasvad ei lahustu vees, kuid lahustuvad hästi orgaanilistes lahustites: eetris, benseenis, kloroformis jne.
Keemilised omadused. Nagu kõik estrid, läbivad rasvad hüdrolüüsi. Hüdrolüüs võib toimuda happelises, neutraalses või aluselises keskkonnas.
1. Happeline hüdrolüüs.
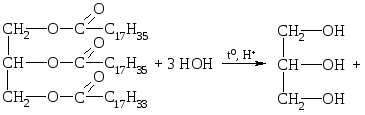
Piimhape
PIIMHAPE(2-hüdroksüpropioonhape) CH 3 CH (OH) COOH, mol. m 90,1; värvitu kristallid. Tuntud D (+) - piimatooted - et, D (-) - piim (liha ja piim) kuni - see ja ratseemiline. Piimhape - piimhape - et käärimine. D, L- ja D-piimhappe puhul, st. acc. 18 °C ja 53 °C; t. kip. acc. 85 ° C / 1 mm Hg ja 103 °C / 2mm Hg; D-piimhappe jaoks [a] D20 -2,26 (kontsentratsioon 1,24% vees). D puhul L-piimhape DH 0 arr - 682,45 kJ / mol; DH 0 pl 11,35 kJ / mol; DH isp 110,95kJ/mol (25 °C), 65,73 kJ/mol (150 °C). L-piimhappe DH 0 põlemisel - 1344,8 kJ / mol; DH 0 obp -694,54 kJ / mol; DH 0 pl 16,87 kJ / mol.
Piimhappe kõrge hügroskoopsuse tõttu kasutatakse tavaliselt selle kontsentraatorit. vesilahused-siirupitaoline värvitu. lõhnatud vedelikud. Piimhappe vesilahustel d 20 4 1,0959 (40%), 1,1883 (80%), 1,2246 (100%); n D 25 1,3718 (37,3%), 1,4244 (88,6%); h 3,09 ja 28,5 mPa. s (25 0 C) resp. 45,48 ja 85,32% lahuste jaoks; g 46,0. 10-3 N / m (25 °C) 1 M lahuse kohta; e 22 (17 °C). Piimhappe sool. vees, etanoolis, halvasti benseenis, kloroformis ja teistes halogeenitud süsivesinikes; pKa 3,862 (25 °C); Vesilahuste pH 1,23 (37,3%), 0,2 (84,0%).
Piimhappe oksüdeerumisega kaasneb tavaliselt lagunemine. HNO 3 või O 2 õhu toimel juuresolekul. Cu või Fe moodustavad HCOOH, CH 3 COOH, (COOH) 2, CH 3 CHO, CO 2 ja püroviinamarihape. Piimhappe HI taastumine toob kaasa propioonhappe ja taastumine toimub. Re-mobile - propüleenglükooliks.
Piimhape dehüdreerub kuumutamisel akrüüliks. koos HBr-ga moodustab koostoimel 2-bromopropioon- et - et. Ca-soolad РСl 5 või SОСl 2 -2-kloropropionüülkloriidiga. Juuresolekul. kaevandaja. to-t piimhappe iseesterdamine toimub laktoon f-ly I, samuti lineaarsete polüestrite moodustumisel. Suhtlemisel. piimhape alkoholidega, tekivad hüdroksühapped RCH 2 CH (OH) COOH ning interaktsiooni käigus. piimhappe soolad koosalkoholi estrid. Piimhappe sooli ja estreid nimetatakse. laktaadid (vt tabelit).
Selle tulemusena moodustub piimhape piimhappe fermentatsioon(piima hapnemisel, kapsa marineerimisel, juurviljade marineerimisel, juustu valmimisel, sööda sileerimisel); D-piimhapet leidub loomade, taimede ja ka mikroorganismide kudedes.
Prom-stis saadakse piimhape 2-kloropropioonhappe ja selle soolade (100 °C) või laktonitriili CH 3 CH (OH) CN (100 ° C, H 2 SO 4) hüdrolüüsil, millele järgneb. estrite moodustumine, mille eraldamine ja hüdrolüüs annab kvaliteetse toote. Piimhappe tootmiseks on teada ka teisi meetodeid: propüleeni oksüdeerimine lämmastikoksiididega (15-20 °C), millele järgneb. töötlemine H 2 SO 4, interaktsioon. CH3CHO koos CO-ga (200 °C, 20 MPa).
MÕNE LAKTAATIDE OMADUSED
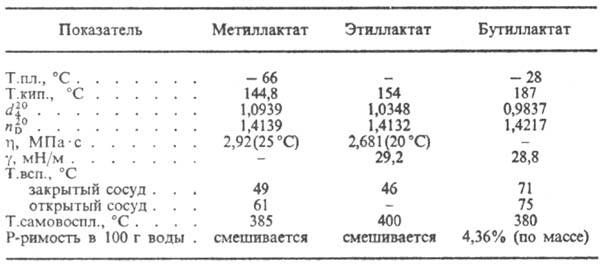
M piimhapet kasutatakse toidus. tööstuses, peitsvärvimisel, parkimistöökojas, kääritustsehhides bakteritsiidse keskkonnana, leki saamiseks. Wed-in, plastifikaatorid. Etüül- ja butüüllaktaate kasutatakse tselluloosi eetrite, kuivatavate õlide, taimede lahustitena. õlid; butüüllaktaat, samuti mõne sünteetilise lahuse lahus. polümeerid.
Piimhape(2-hüdroksüpropioonhape) CH 3 CH (OH) COOH, molekulmass 90,1; värvitu. Tuntud L (+) - piimhape, D (-) - piim (liha-piim)hape ja ratseemiline piimhape-piimhape fermentatsioon. D-, L- ja D-piimhappe puhul vastab sulamistemperatuur 18 °C ja 53 °C; t. kip. acc. 85 ° C / 1 mm Hg ja 103 °C / 2mm Hg; D-piimhappe jaoks [α] D 20 -2,26 (kontsentratsioon 1,24% tolli D puhul L-piimhape D H 0 proov - 682,45 kJ / mol; D H 0 pl 11,35 kJ / mol; D H isp 110,95 kJ/mol (25 °C), 65,73 kJ/mol (150 °C). L-piimhappe D jaoks H 0 põlemine - 1344,8 kJ / mol; D H 0 vp -694,54 kJ / mol; D H 0 pl 16,87 kJ / mol.
Piimhappe kõrge hügroskoopsuse tõttu kasutatakse tavaliselt selle kontsentreeritud vesilahuseid - siirupisi, värvituid, lõhnatuid. Sest vesilahused piimhape d 20 4 1,0959 (40%), 1,1883 (80%), 1,2246 (100%); n D 25 1,3718 (37,3%), 1,4244 (88,6%); h 3,09 ja 28,5 mPa. s (25 0 C) resp. 45,48 ja 85,32% lahuste jaoks; g 46,0. 10-3 N / m (25 °C) 1 M lahuse kohta; e 22 (17 °C). Piimhape lahustub halvasti ja muudes halogeenitud süsivesinikes; R K a 3,862 (25 °C); Vesilahuste pH 1,23 (37,3%), 0,2 (84,0%).
Piimhape dehüdreerub akrüülhappeks, kuumutamisel HBr-ga moodustab 2-bromopropioonhappe, kui Ca sool reageerib PCl5 või SOCl2-2-kloropropionüülkloriidiga. Mineraalhapete juuresolekul toimub piimhappe iseesterdamine valemiga I, aga ka lineaarsete polüestrite moodustumisega. Piimhappe interaktsioonil tekivad hüdroksühapped RCH 2 CH (OH) COOH ja piimhappe interaktsioonil alkoholidega tekivad estrid. Piimhappe sooli ja estreid nimetatakse laktaatideks (vt tabelit).
piimhape tekib piimhappe tulemusena (hapupiima, hapukapsa, köögiviljade marineerimise, juustu valmimise, sööda sileerimisega); D-piimhapet leidub loomade, taimede ja ka mikroorganismide kudedes.
Tööstuses saadakse piimhapet 2-kloropropioonhape ja selle (100 °C) või laktonitriil CH 3 CH (OH) CN (100 °C, H 2 SO 4), millele järgneb estrite moodustumine, nende eraldamine ja hüdrolüüs. mis viib kvaliteetse tooteni. Tuntud on ka teisi piimhappe valmistamise meetodeid: propüleeni oksüdeerimine lämmastikoksiididega (15-20 °C), millele järgneb töötlemine H2SO4-ga, CH3CHO interaktsioon CO-ga (200 °C, 20 MPa).
MÕNE LAKTAATIDE OMADUSED

piimhapet kasutatakse toiduainetööstuses, peitsvärvimisel, nahatootmises, fermentatsioonitsehhides bakteritsiidsena, saamaks ravimid, plastifikaatorid. Etüül- ja butüüllaktaate kasutatakse lahustitena tselluloosi eetrite, õlide kuivatamisel, taimeõlid; butüüllaktaat – samuti mõnede sünteetiliste polümeeride lahusti.
Maailma piimhappetoodang 40 tuhat tonni (1983).
Valgus .: Holten C.H., Piimhape. Omadused ja keemia. Piimhape ja selle derivaadid, Weisheim, 1971. Yu.A. Treger.
Valige artikli pealkirja esimene täht:
Piimhappe kataloogi number: CAS 50-21-5
Piimhappe kirjeldus:
Peaaegu läbipaistev, kergelt kollakas, kergelt hapuka lõhnaga hügroskoopne siirupjas vedelik, mis meenutab jogurtit. See lahustub vees, etanoolis, halvasti - benseenis, kloroformis ja teistes halogeenitud süsivesinikes. D- ja L-vormis on mitmesuguseid optiliselt aktiivseid isomeere. Ja ka optiliselt inaktiivne segu D ja L. Viimane saadakse keemilise sünteesi teel, aktiivsed vormid aga bakteriaalsel teel. (ensüümmeetod) Inimese organismis võtab Krepsi tsüklist osa just optiliselt aktiivne vorm L, mistõttu on soovitatav seda kasutada lisandina (piimhape, E270), teistes tööstusharudes see ei mängi. eriline roll.
Ülemaailmne nimi piimhape pole Venemaal juurdunud, kuid selle laktaatsoolade nimetusi leidub kõikjal, palju sagedamini kui kaltsiumpiimhapet, kriipsutame kaltsiumlaktaati.
Piimhappe spetsifikatsioon 80%.
Keemistemperatuur (100% lahus) 122 °C (115 mm Hg)
Erikaal(20 °C) 1,22
Vees lahustuvus Täielikult lahustuv
Tihedus (20 ° С juures) 1,18-1,20 g / ml
Raskmetallid, mitte rohkem kui 0,001%
rauasisaldus, mitte üle 0,001%
Arseenisisaldus, mitte üle 0,0001%
Kloriidisisaldus mitte üle 0,002% (tegelikult 0,0015%)
Sulfaadisisaldus, mitte üle 0,01% (tegelikult 0,004%)
Jääk pärast kaltsineerimist, mitte üle 0,1% (tegelikult 0,06%)
Tootja: Hiina
Pakkimine: tünnid 25 kg või kuubikud 1200 kg
Piimhappe peamised füüsikalised omadused:
Sulamistemperatuur: 17 °C Optiliselt mitteaktiivse (ratseemilise),
25-26 ° C optiliselt aktiivne + või - vorm
(sulamistemperatuuride erinevused võimaldavad kvaliteetselt ja kiiresti eristada kallimaid optiliselt aktiivseid vorme odavamatest mitteaktiivsetest !!)
Suhteline tihedus (vesi = 1): 1.2
Vees lahustuvus: segunev
Molekulmass: 90,08 g/mol
Leekpunkt: 110 °C c.c.
Oktanool/vesi jaotuskoefitsient log Pow: -0,6
Plahvatus- ja tuleoht:
Toetab põlemist tavatingimustes. isesüttimine on ebatõenäolineÄrge laske lahtisel tulel suitsetada.
Tulekustutus: pulber, alkoholikindel vaht, pihustatud vesi,
süsinikdioksiid.
Keemiline stabiilsus: Tall kl normaalsed temperatuurid ja survet.
Välditavad tingimused: Tolmu teke, liigne kuumenemine.
Kokkusobimatus teiste materjalidega: Tugevad oksüdeerijad, mineraalhapped.
Ohtlikud lagunemissaadused: lämmastikoksiidid, süsinikmonooksiid, süsinikdioksiid, paarid
tsüaniid.
Ohtlik polümerisatsioon: Pole kontrollitud.
Oht inimestele:
Kehasse sisenemise teed: Ained võivad imenduda kehasse. aerosoolide sissehingamise kaudu ja seedeelundkonna kaudu .
Lühiajalise kokkupuute korral MPC-d ületavate kontsentratsioonidega: Aine ärritab nahka ja Hingamisteed ja sellel on ka söövitav aine
mõju silmadele. Allaneelamisel söövitav.
Silma sattumisel: Punetus. Valu. Rasked sügavad põletused. Kaitseprillid või
kaitsemask. Esmalt loputage rohke veega mitu korda
minutit (eemaldage kontaktläätsed kui pole raske), siis pöörduge arsti poole.
Tööpiirkonna standardid:
TLV (Threshold Limit Value, USA) pole kehtestatud.
Kantserogeensus: Ei ole loetletud ACGIH, IARC, NTP ega CA Prop 65 poolt.
Epidemioloogia: Pole informatsiooni.
Tetratogeensus: Pole informatsiooni.
Reproduktiivmõju: Pole informatsiooni.
Mutageensus: pole informatsiooni
Neurotoksilisus: Pole informatsiooni.
Loomkatsed on näidanud:
LD50 / LC50:
Draize test, küülik, silmad: 100 mg Raske;
Draize test, küülik, nahk: 500 mg / 24H Kerge;
Sissehingamine, rott: LC50 => 26 mg/m (kuubik) / 1H;
Suukaudne, hiir: LD50 = 1940 mg / kg;
Suukaudne, rott: LD50 = 1700 mg / kg;
Küüliku nahk: LD50 => 10 g/kg;
Tähelepanu. Teave on antud aine kontsentraadi kohta, väikestes kogustes ja piimhappe kontsentratsioonides, hetkel olemasolevatel andmetel on see kahjutu!