Sporočilo na temo kemičnega elementa zlata. Lastnosti zlata. Fizikalne in kemijske lastnosti zlata. Oksidacijska stanja zlata, njegova vez s halogeni in sodelovanje v spojinah
Izpolnil: študent skupine SP - 00 - D1 Ivanov Sergej Tihonovič
Preveril: Egorov S.N.
Volgodonsk
V povezavi s hitrim razvojem komunikacijske tehnologije, elektronske, letalske, vesoljske in drugih panog je zanimanje za zlato močno naraslo. Trenutno je razvito veliko število novih zlatih zlitin, pa tudi tehnološki postopki za nanašanje pozlačenja in pridobivanje večplastnih materialov.
Razširjenost zlata v naravi
Zemljina skorja vsebuje 20-krat manj zlata kot srebra in 200-krat manj kot živega srebra. Neenakomerna porazdelitev zlata v različnih delih zemeljske skorje otežuje preučevanje njegovih geokemičnih značilnosti. Morja in oceani vsebujejo približno 10 milijard ton zlata. Približno enaka količina zlata je v rečnih in podzemnih vodah.
Povečana vsebnost zlata je v vodah izvirov in rek, ki tečejo na zlatonosnih območjih. V naravi se zlato nahaja predvsem v naravni obliki in je mineral, ki je trdna raztopina srebra v zlatu, ki vsebuje do 43 % Ag, s primesmi bakra, železa, svinca, redkeje bizmuta, živega srebra, platine, mangana. in drugi elementi. Poleg tega najdemo zlato v obliki naravnih amalgamov, pa tudi kemičnih spojin - solenidov in teluridov. Po velikosti delcev se samorodno zlato deli na fino (1 - 5 mikronov), prašno (5 - 50 mikronov), fino (0,05 - 2 mm) in grobo (več kot 2 mm). Delci, ki tehtajo več kot 5 g, so drobci. Največji nuggets - "Halterman Plate" (285 kg) in "The Desired Stranger" (71 kg) so našli v Avstraliji. Najdbe nuggetov so znane v številnih regijah Urala, Sibirije, Jakutije in Kolima. Samorodno zlato je koncentrirano v hidrotermalnih nahajališčih.
Depoziti zlata so razdeljeni na primarne in razsute. Najdišča zlata so nastala v različnih geoloških obdobjih na različnih globinah - od deset metrov do 4 - 5 km od zemeljske površine. Primarna nahajališča predstavljajo žile, sistemi žil, nahajališča in cone žilno - razpršenih rud v razponu od deset do tisoč metrov. V dolgem obdobju zgodovine Zemlje so bile gore uničene in voda je odnesla vse, kar se v rekah ni raztopilo. Hkrati so se težki minerali ločili iz pljuč in se kopičili na mestih, kjer je pretok nizek. Tako so nastajale usedline s koncentracijo relativno velikega zlata. Industrijski nasipi se praviloma oblikujejo relativno blizu primarnih nahajališč. Določen del mikroskopskih delcev zlata ostane v nasipih, vendar zaradi nezmožnosti njegove ekstrakcije nima praktične vrednosti. Del mikroskopskih in koloidnih delcev zlata se z vodnimi viri odnese v morja, oceane in jezera, kjer se razprši v obliki najfinejših suspenzij ali je v muljastih usedlinah. Tako se zaradi delovanja erozijskih procesov večina zlata nepovratno izgubi.
Kemijske lastnosti
Kljub dejstvu, da je zlato v periodičnem sistemu D.I.Mendelejeva v isti skupini s srebrom in bakrom, so njegove kemijske lastnosti veliko bližje kemičnim lastnostim kovin skupine platine. Elektrodni potencial para Au - Au (111) je - 1,5 V. Zaradi tako visoke vrednosti na zlato ne delujejo razredčeni in koncentrirani HCI, HNO, HSO. Vendar pa se v HCI raztopi v prisotnosti oksidantov, kot so magnezijev dioksid, železov klorid in baker, pa tudi pod visokim tlakom in visoko temperaturo v prisotnosti kisika. Zlato se zlahka raztopi tudi v mešanici HCI in HNO (kraljevska voda). Kemično je zlato neaktivna kovina. Na zraku se ne spremeni, tudi pri močnem segrevanju. Zlato se zlahka raztopi v klorovi vodi in v prezračenih raztopinah cianidov alkalijskih kovin. Živo srebro raztaplja tudi zlato, pri čemer tvori amalgam, ki postane trden pri več kot 15 % zlata. Znani sta dve seriji zlatih spojin, ki ustrezata oksidacijskim stanjema +1 in +3. Torej, zlato tvori dva oksida - zlati oksid(1) oz zlati oksid, AuO in zlati oksid(111), oz zlati oksid, AuO. Spojine, v katerih ima zlato oksidacijsko stanje +3, so bolj stabilne. Zlate spojine se zlahka reducirajo v kovino. Reduktorji so lahko vodik pod visokim pritiskom, številne kovine v območju napetosti do zlata, vodikov peroksid, dva kositrov klorid, železov sulfat, titanov triklorid, svinčev oksid, manganov dioksid, peroksidi alkalijskih in zemeljskoalkalijskih kovin. Za obnavljanje zlata se uporabljajo tudi različne organske snovi: mravljinčna in oksalna kislina, hidrokinon, hidrazin, metol, acetilen itd. tvorbe ustreznih ionov. Najpogostejše spojine sta enovalentno in trivalentno zlato. Pogosto jih obravnavamo kot kompleksne molekule, sestavljene iz enakega števila atomov Au (1) in Au (3). Trivalentno zlato je zelo močan oksidant in tvori številne stabilne spojine. Zlato se združuje s klorom, fluorom, jodom, kisikom, žveplom, telurom in selenom.Fizikalne in mehanske lastnosti
Zlato je že dolgo predmet znanstvenih raziskav in spada med kovine, katerih lastnosti so bile dovolj globoko raziskane. Atomsko število zlata je 79, atomska masa je 197,967, atomska prostornina pa 10,2 cm / mol. Naravno zlato je monoizotopno in je v normalnih pogojih inertno glede na večino organskih in anorganskih snovi. Zlato ima stransko osredotočeno kubično mrežo in ni podvrženo alotropskim transformacijam. Mrežna konstanta a je 4,07855 A pri 25 C, kar ustreza vrednosti 4,0724 A pri 20 C. Učinek pritiska na gostoto zlata je prikazan na sliki:
0 100 200 300 400
Velika odstopanja obstajajo kot posledica merjenja temperature taljenja zlata - od 1062,7 do 1067,4 C. Praviloma se šteje, da je tališče zlata 1063 C. Toplota sublimacije zlata pri 25 C je 87,94 kcal. Površinska napetost staljenega zlata je 1,134 J / m. Toplotna prevodnost zlata l pri 20 C je 0,743 cal in se z naraščanjem temperature malo spreminja. Pri nizkih temperaturah opazimo največjo toplotno prevodnost pri 10 K. Temperaturni koeficient električne upornosti pri 0 - 100 C je 0,004 C. Obsevanje, delovno utrjevanje in gašenje svinca zlatega, kot posledica nastanka defektov mreže, do majhnih sprememb parametra rešetke in prostornine kovine. Vendar te spremembe niso zelo pomembne, linearne dimenzije se spremenijo le za nekaj stotink odstotka. V procesu žarjenja pride do toplotnega vračanja lastnosti, katerih sprememba je nastala zaradi napak v mrežici. Za čisto zlato je značilna nizka vrednost končne trdnosti s - približno 13 - 13,3 kgf / mm - in visoka vrednost relativnega raztezka - približno 50% - v žarjenem stanju. Točka tečenja s je tudi zelo nizka, enaka 0,35 kgf / mm. Okrepitev med plastično deformacijo je zelo nepomembna zaradi nagnjenosti zlata k rekristalizaciji med deformacijo.
Uporaba zlata v znanosti in tehnologiji
Že tisočletja se zlato uporablja za izdelavo nakita in kovancev, uporabo zlata za zobno protetiko pa poznajo že stari Egipčani. Uporaba zlata v steklarski industriji je znana že od konca 17. stoletja. Zlata folija, kasneje pa tudi galvanizacija, je bila široko uporabljena za pozlačevanje kupol cerkvenih templjev. Samo zadnjih 40 - 45 let je mogoče pripisati obdobju čisto tehnične uporabe zlata. Zlato ima edinstven niz lastnosti, ki jih nima nobena druga kovina. Ima najvišjo odpornost na agresivne medije, po električni in toplotni prevodnosti je na drugem mestu za srebrom in bakrom, zlato jedro ima velik presek zajetja nevtronov, sposobnost zlata, da odbija infrardeče žarke, je blizu 100% , v zlitinah ima katalitične lastnosti. Zlato je tehnološko zelo napredno, iz njega je enostavno izdelati ultra tanko folijo in mikronsko žico. Pozlačenje se zlahka nanaša na kovine in keramiko. Zlato je dobro spajkano in tlačno varjeno. Ta kombinacija uporabnih lastnosti je privedla do široke uporabe zlata v najpomembnejših sodobnih vejah tehnologije: elektroniki, komunikacijski tehnologiji, vesoljski in letalski tehnologiji, kemiji.
Treba je opozoriti, da se 90 % zlata uporablja v elektroniki v obliki premazov. Elektronika in z njo povezane inženirske industrije so glavni porabniki zlata v tehnologiji. Na tem področju se zlato pogosto uporablja za povezovanje integriranih vezij s tlačnim ali ultrazvočnim varjenjem, kontaktov vtičnih konektorjev, kot tanke žice, za spajkanje tranzistorskih elementov in druge namene. V slednjem primeru je še posebej pomembno, da zlato tvori nizko talne evtektike z indijem, galijem, silicijem in drugimi elementi, ki imajo določeno prevodnost. Poleg tehnoloških izboljšav v elektroniki so za številne dele in sklope namesto zlata začeli uporabljati paladij, kositrne prevleke, kositer-svinčeve zlitine in zlitino 65 % Sn + 35 % Ni z zlato podslojo. Zlitina kositra z nikljem ima visoko odpornost proti obrabi, odpornost proti koroziji, sprejemljivo kontaktno odpornost in električno prevodnost. Kljub temu, da se trenutno poraba zlata v elektroniki nenehno povečuje, se domneva, da bi bila lahko 30 % večja, če ne bi bilo ukrepov za varčevanje zlata.
V mikroelektroniki se pogosto uporabljajo paste na osnovi zlata z različnim električnim uporom. Široka uporaba zlata in njegovih zlitin za kontakte nizkotokovne opreme je posledica njegovih visokih električnih in korozivnih lastnosti. Srebro, platina in njihove zlitine, ko se uporabljajo kot kontakti za preklapljanje mikrotokov pri mikronapetosti, dajejo veliko slabše rezultate. Srebro v ozračju, onesnaženem z vodikovim sulfidom, hitro porjavi, medtem ko platina polimerizira organske spojine. Zlato nima teh pomanjkljivosti, njegovi kontakti iz zlitine pa zagotavljajo visoko zanesljivost in dolgo življenjsko dobo. Zlate spajke z nizkim parnim tlakom se uporabljajo za spajkanje vakuumsko tesnih šivov delov elektronskih cevi, pa tudi za spajkanje sklopov v letalski industriji.
Zlitine zlata s kobaltom ali kromom se uporabljajo v merilni tehniki za nadzor temperature in predvsem za merjenje nizkih temperatur. V kemični industriji se zlato uporablja predvsem za oblaganje jeklenih cevi za transport korozivnih snovi.
Zlate zlitine se uporabljajo pri izdelavi ohišja ur in peres za nalivna peresa. V medicini se ne uporabljajo samo protetične zlitine zlata, temveč tudi zdravilni pripravki, ki vsebujejo zlate soli za različne namene, na primer pri zdravljenju tuberkuloze. Radioaktivno zlato se uporablja pri zdravljenju malignih tumorjev. V znanstvenih raziskavah se zlato uporablja za zajemanje počasnih nevtronov. S pomočjo radioaktivnih izotopov zlata preučujemo difuzijske procese v kovinah in zlitinah.
Zlato se uporablja za metalizacijo okenskih stekel v stavbah. V vročih poletnih mesecih skozi steklene plošče stavb prehaja znatna količina infrardečega sevanja. V teh okoliščinah tanek film (0,13 µm) odbija infrardeče sevanje in prostor postane veliko hladnejši. Če skozi takšno steklo preide tok, bo pridobilo lastnosti proti meglenju. Pozlačena stekla za ogled ladij, električnih lokomotiv itd. učinkovit v vsakem letnem času.
Denarna in finančna vrednost zlata
Pred pojavom kovancev so palice ali prstani iz zlata, srebra ali bakra služili kot plačilno sredstvo, kar je povzročilo velike nevšečnosti v trgovskih naseljih. Ingote je bilo treba stehtati, razdeliti na manjše. To je bil odločilen predpogoj za prehod na kovanje kovancev.
Večina raziskovalcev meni, da je bil prvi zlati kovanec kovan v 7. stoletju. pr. v Lydiji iz zlitine, ki vsebuje 73 % Au in 27 % Ag. Malo kasneje so v stari Grčiji začeli kovati zlate kovance. V državah Sredozemlja in Bližnjega vzhoda so bili poleg zlatih v obtoku srebrniki, kar kaže na zgodnji izvor bimetalizma. Razmerje vrednosti med zlatom in srebrom je bilo različno, odvisno od dobe in razpoložljivosti teh kovin. Po Plinijevem pričevanju so Rimljani izbili prvi zlati kovanec v 3. stoletju. pr. Sama beseda "kovanec" izhaja iz imena rimskega templja Juno - Moneta, kjer je bila organizirana prva rimska kovnica.
V začetku XIX stoletja. prehod na zlati standard je načrtovan v Veliki Britaniji, zakonodajno - konec 18. stoletja, pravzaprav - leta 1823. V Franciji, Nemčiji, Rusiji, na Japonskem in v ZDA je bil prehod na monometalni denarni sistem končan. v zadnji četrtini 19. stoletja. Najvišja oblika zlatega standarda je bil standard zlatih kovancev, za katerega je značilno prosto kroženje v notranjem obtoku zlatih kovancev in njihovo brezplačno kovanje, neomejena menjava za papirnati denar po trdnih paritetah, prost uvoz in izvoz zlata v tujino.
Prosti pretok zlata je v največji meri ustrezal zahtevam sistema svobodnega podjetništva, služil je razvoju mednarodnih monetarnih odnosov, ki so se postopoma oblikovali v denarnem sistemu.
Zajetnost zlatnikov in s tem povezane neprijetnosti in stroški pri transportu, postopna obraba kovancev ter stroški obtoka so bili objektivni razlogi za prehod na papirnati denar.
Visoke cene zlata spodbujajo razvoj njegovih nadomestkov, vendar je jasno, da univerzalnega nadomestka za zlato ni mogoče najti. O zamenjavi zlata s cenejšim materialom lahko govorimo le v ločenih napravah, kjer delovni pogoji to omogočajo. Če upoštevamo rast vesoljskih programov, potem lahko pričakujemo občutno povečanje tehnične uporabe zlata. Brez dvoma, če ne bi bilo posebnih denarnih funkcij zlata, bi bila ta kovina danes veliko bolj razširjena v tehnologiji.
15.10.2015
Zlato je morda najstarejša snov, ki so jo kopali že od nekdaj. Morda je to celo prva kovina, s katero se je srečalo naše človeštvo. Njegova prva omemba v Indiji sega v leto 2000-1500 pr.n.št., kjer so iz njega izdelovali različne vrste nakita in umetniških del. V domačem stanju so ga srečali v 5. stoletju pr.
Znanstveniki domnevajo, da se je zgodovina distribucije začela na Bližnjem vzhodu. Od tu so kovino dobavljali v Egipt, kjer je postala simbol bogastva in razkošja. Tako so med izkopavanjem grobnice našli pokrivalo, ki je pripadalo kraljici sumerskega ljudstva že 3000 let pred našim štetjem. Na steni na grobišču je bila podoba obrtnika, ki kopa zlato. Tudi grobnica znanega faraona Tutankamona je bila okrašena z več zlatimi okraski.
V tistih dneh je veljalo, da takšni predmeti kot znak moči spremljajo pokojne kralje v drug svet. Vse zlato, izdelano pred 6. stoletjem pr bila je »umazana« s primesmi bakra, srebra itd., kasneje so se v Egiptu naučili pridobivati najčistejšo kovino na nahajališčih v Nubiji. Od tod izvira starodavno ime zlata - noob... Sanskrtska beseda zlato prevaja kot rumeno, latinsko ime pa je aurum- nanašajte se na besedo Aurora, kar v prevodu pomeni Jutranja zarja.
Na ozemlju Rusije so rudnike odkrili precej pozneje, saj je bilo vse zlato sem uvoženo v obliki denarja in dajatev. Šele v 17. stoletju so v provinci Arkhangelsk začeli kopati kovino. Za začetek odkritja se šteje že 18. stoletje, ko je razkolnik Markov Erofei našel neopazen kamen in ga prijavil kancelariji upravnega odbora jekaterinburških tovarn. Na tem mestu je bil ustanovljen rudnik "Primordial". V prvem desetletju je bilo na njem izkopanih skoraj 6000 kg, delo je bilo zelo težko in se je pozneje začelo šteti za težko delo.
Vsebnost zlata v naravi je izjemno majhna, dokazano je, da ga vsebuje tudi voda. Tako je na primer do 5 kg kovine na 1 km 3. Nekateri observatoriji, ki raziskujejo vesolje, lahko zaznajo nastanek zlata, ki po novi teoriji nastane kot posledica razpada nevtronskih zvezd. Bistvo teorije je naslednje - prah, ki nastane kot posledica razpadanja, pade v vesolje, se tam kopiči. Na Zemljo pride zahvaljujoč asteroidom.
Zlate kepe pogosto najdemo v naravi v obliki rude, medtem ko so kemične spojine zlata, nasprotno, izjemno redke. To so predvsem teluridi, zlato pa je lahko prisotno tudi v sulfidnih mineralih. Čistost te kovine je določena v karatih in v vzorcih. Najčistejše zlato ustreza 24 karatom (24 delov zlitine je enako 24 delov zlata). Vzorec 575 se običajno bere takole, zlitina 1000 delov vsebuje 575 zlata. Ingoti, ki se proizvajajo s posebnimi metodami rafiniranja za različne finančne institucije in druge pomembne strukture, imajo finost 999,9
Zlato velja za glavno kovino, zaradi katere je bilo izstreljenih več kot ducat bojevnikov. Zagotovo so znane takšne »zlate bitke«, kot so osvajanje Babilona s strani perzijskega kralja, bitka Aleksandra Velikega za Perzijo, Cezarjevi uničujoči napadi v Egipt in Galijo. Danes je zlato ostalo valutna kovina, njegova proizvodnja pa tudi nenehno raste.
Zlato (angleško Gold, francosko ali, nemško zlato) je ena od sedmih kovin antike. Na splošno velja, da je bilo zlato prva kovina, ki so jo ljudje srečali v kameni dobi zaradi svoje razširjenosti v domači državi. Posebne lastnosti zlata - težo, lesk, neoksidativnost, kovnost, duktilnost - pojasnjujejo, zakaj so ga že od najstarejših časov začeli uporabljati predvsem za izdelavo nakita in deloma za orožje. Zlate predmete za različne namene so arheologi našli v kulturnih plasteh, ki segajo v 4. in celo 5. tisočletje pred našim štetjem, t.j. do neolitika. V III in II tisočletju pr. NS. zlato je bilo že razširjeno v Egiptu, Mezopotamiji, Indiji, na Kitajskem, že od antičnih časov je bilo znano kot plemenita kovina ljudstvom ameriške in evropske celine. Zlato, iz katerega je izdelan najstarejši nakit, je nečisto, vsebuje precejšnje primesi srebra, bakra in drugih kovin. Šele v VI stoletju. pr NS. v Egiptu se je pojavilo skoraj čisto zlato (99,8 %). V dobi Srednjega kraljestva se je začel razvoj nubijskih nahajališč zlata (Nubija ali antična Etiopija). Od tod staroegipčansko ime za zlato - nub (Nub). V Mezopotamiji so obsežno kopanje zlata izvajali že v II tisočletju pred našim štetjem. NS. Babilonsko ime za zlato - hure - shu (hurasu) ima daleč podobnost s starogrško besedo (chrysos), ki jo najdemo v vseh najstarejših literarnih spomenikih. Morda ta beseda izvira iz imena območja, od koder bi lahko prišlo zlato. Starodavni indijski ayas (zlato) je bil kasneje uporabljen v drugih jezikih za označevanje bakra, kar lahko kaže na širjenje ponarejenega zlata v antiki. Že od antičnih časov so zlato primerjali s soncem, imenovali so ga sončna kovina ali preprosto sonce (Sol). V egipčanski helenistični literaturi in med alkimisti je simbol zlata krog s piko na sredini, t.j. enako kot simbol sonca. Včasih je v grški alkimistični literaturi simbol v obliki kroga s podobo žarka, ki je povezan z njim.
Zlato kot najbolj žlahtna kovina že dolgo služi kot menjalni ekvivalent v trgovini in v zvezi s tem so se pojavile metode izdelave zlatu podobnih zlitin na osnovi bakra. Te metode so bile široko razvite in razširjene in so služile kot osnova za nastanek alkimije. Glavni cilj alkimistov je bil najti načine za pretvorbo (pretvorbo) navadnih kovin v zlato in srebro. Evropski alkimisti so po stopinjah Arabcev razvili teorijo »popolnega« ali celo »super popolnega« zlata, katerega dodatek navadni kovini spremeni slednje v zlato. V alkimistični literaturi je veliko imen za zlato, običajno šifriranih: zaras, tricor, sol, sonce (Sonir), secur, senior itd. Nekatera od njih so arabskega izvora, npr. al-bahag (veselje), hiti (mačji iztrebki ), ras (glava, načelo), su "a (žarek), diya (svetloba), alam (mir).
Latinsko (etruščansko) ime za zlato aurum (Aurum, starodavni ausom) pomeni "rumeno". Ta beseda se dobro ujema s starorimsko auroro ali ausosa (zora, vzhodna dežela, vzhod). Po Schroederju beseda zlato pri ljudstvu srednje Evrope pomeni tudi rumeno: v starem germanskem jeziku - gulth, gelo, gelva, v litovščini - geltas, v slovanskem - zlato, v finščini - kulda. Nekatera sibirska ljudstva zlato imenujejo altun, stari Perzijci ga imenujejo zarania (ali zar), kar primerjajo s staroindijsko hiranijo (pogosteje pa se nanaša na srebro) in starogrško (nebesa). Armensko ime za zlato - oski - stoji ločeno. Slovansko zlato ali zlato, ki se uporablja že od antičnih časov, je nedvomno povezano (v nasprotju s Schroederjem) z najstarejšim indoevropskim Sol (sonce), verjetno pa tudi srednjeevropsko zlato (gelb) z grškim (sonce).
Takšna raznolikost imen zlata priča o širokem poznavanju različnih starodavnih ljudstev in plemen ter o križanju različnih plemenskih imen. Izpeljanka imena zlatih spojin, ki se trenutno uporabljajo, prihajajo iz latinskega aurum, ruskega "zlato" in grščine.
Edinstvene kemične lastnosti zlata so mu dale posebno mesto med kovinami, ki se uporabljajo na Zemlji. Zlato je človeštvu poznano že od antičnih časov. Že od antičnih časov so ga uporabljali kot nakit, alkimisti so poskušali odstraniti žlahtno kovino iz drugih manj plemenitih snovi. Trenutno povpraševanje po njem le raste. Uporablja se v industriji, medicini, tehnologiji. Poleg tega ga kupujejo tako države kot posamezniki, ki ga uporabljajo kot naložbeno kovino.
Kemijske lastnosti "kralja kovin"
Znak Au se uporablja za označevanje zlata. To je okrajšava za latinsko ime kovine - Aurum. V periodičnem sistemu Mendelejeva je oštevilčen 79 in se nahaja v skupini 11. Po videzu je rumena kovina. Zlato je v isti skupini z bakrom, srebrom in rentgenskimi žarki, vendar so njegove kemijske lastnosti bližje kovinam platinske skupine.
Inertnost je ključna lastnost tega kemičnega elementa, kar je mogoče zaradi visoke vrednosti elektrodnega potenciala. V standardnih pogojih zlato ne sodeluje z ničemer, razen z živim srebrom. Z njim ta kemični element tvori amalgam, ki se pri segrevanju na le 750 stopinj Celzija zlahka razgradi.
Kemijske lastnosti elementa so takšne, da so tudi druge spojine z njim kratkotrajne. Ta lastnost se aktivno uporablja pri pridobivanju plemenitih kovin. Reaktivnost zlata se znatno poveča le pri intenzivnem segrevanju. Na primer, lahko ga raztopimo v klorovi ali bromovi vodi, alkoholni raztopini joda in seveda v aqua regia - mešanici klorovodikove in dušikove kisline v določenem razmerju. Kemična formula za reakcijo takšne spojine je: 4HCl + HNO 3 + Au = H (AuCl 4) + NO + 2H 2.
Kemija zlata je taka, da pri segrevanju lahko komunicira s halogeni. Za tvorbo zlatih soli je treba ta kemični element obnoviti iz kisle raztopine. V tem primeru se soli ne bodo oborile, ampak se bodo raztopile v tekočino in tvorile koloidne raztopine različnih barv.
Kljub dejstvu, da zlato ne vstopa v aktivne kemične reakcije s snovmi, v vsakdanjem življenju ne bi smeli dovoliti interakcije izdelkov iz njega z živim srebrom, klorom in jodom. Različne gospodinjske kemikalije tudi niso najboljši sosed za izdelke iz plemenitih kovin.
Dejstvo je, da se v nakitu uporablja zlitina zlata z drugimi kovinami in različne snovi, ki medsebojno delujejo s temi nečistočami, lahko povzročijo nepopravljivo škodo lepoti izdelka. Če zlato segrejete nad 100 stopinj Celzija, se bo na njegovi površini pojavil oksidni film z debelino milijoninke milimetra.
Druge lastnosti plemenitih kovin
Zlato je ena najtežjih znanih kovin. Njegova gostota je 19,3 g / cm 3. Ingot, ki tehta 1 kilogram, ima zelo majhne dimenzije, 8x4x1,8 centimetra. To je standardna velikost bančne zlate palice te teže. Primerljiva je z velikostjo navadne kreditne kartice, čeprav je palica nekoliko debelejša.
Težji od zlata, le nekaj kemičnih elementov: plutonij, osmij, iridij, platina in renij. Toda njihova vsebnost v zemeljski skorji, tudi če vzamemo skupaj, je veliko manjša od te plemenite kovine. Poleg tega je plutonij (kemični znak Pu, ki ga ne smemo zamenjevati s Pt - to je znak platine) radioaktivni element.
 Kemična sestava zlata zagotavlja njegove fizikalne lastnosti. Torej, glavne lastnosti te kovine, zaradi katerih je edinstvena, vključujejo:
Kemična sestava zlata zagotavlja njegove fizikalne lastnosti. Torej, glavne lastnosti te kovine, zaradi katerih je edinstvena, vključujejo:
- Gibljivost, duktilnost, duktilnost. Zelo enostavno ga je sploščiti ali izvleči. Torej, iz samo enega grama zlata lahko dobite žico dolžine 3 kilometre, površina tankih listov, pridobljenih iz 1 kilograma, pa bo 530 kvadratnih metrov. Super tanke plošče zlate folije se imenujejo "zlati listi". Pokrivajo na primer cerkvene kupole in notranjo dekoracijo palač. Zaradi svoje duktilnosti lahko majhna količina rumene kovine pokrije velikanska območja.
- Mehkoba. Visokokakovostno zlato je dovolj mehko, da ga lahko opraskate tudi z nohtom. Zato se pločevinke prodajajo v zaprti plastični embalaži. Če se na njem opazi vsaj ena majhna praska, bo prepoznana kot pomanjkljiva. Da bi zlato postalo bolj trpežno, mu pri izdelavi izdelkov dodajajo druge kovine. Ta lastnost je zagotovila visoko priljubljenost kralja kovin v industriji nakita.
- Visoka električna prevodnost. Zaradi te kemične lastnosti je zlato zelo cenjeno v elektrotehniki in industriji. Le srebro in baker prevajata elektriko bolje od nje. Hkrati se zlato skoraj ne segreje: kar zadeva toplotno prevodnost, so diamant, srebro in baker višji od njega. Skupaj s takšnimi lastnostmi, kot je odpornost proti oksidaciji, je zlato idealna snov za izdelavo polprevodnikov.
- Odsev infrardeče svetlobe. Najtanjše, naneseno na steklo, ne prepušča infrardečega sevanja, tako da ostane vidni del spektra. Ta lastnost se aktivno uporablja v astronavtiki, ko je treba zaščititi oči astronavtov pred škodljivimi učinki sonca. Pogosto se škropljenje uporablja tudi v sistemu ogledal visokih stavb, da se zmanjšajo stroški hlajenja prostorov.
- Odporen proti koroziji in oksidaciji. Ingoti, ki so shranjeni v skladu s pravili, praktično niso podvrženi nobenemu kemičnemu vplivu tudi pri interakciji z zrakom. Tako je velika ohranjenost zlata zagotovila njegovo visoko priljubljenost.
Metoda pridobivanja zlata
Zlato je na Zemlji dokaj redek element. Njegova vsebnost v zemeljski skorji je majhna. Najdemo ga predvsem v obliki nasipov v samorodnem stanju ali v obliki rude, občasno pa se pojavlja tudi v obliki mineralov. Včasih se zlato kopa kot spremljevalna snov pri razvoju bakrovih ali polikovinskih rud.
Človeštvo pozna veliko načinov pridobivanja te plemenite kovine. Najpreprostejša je elutriacija, to je ločevanje zlate rude od odpadne kamnine po posebni procesni tehnologiji. Vendar pa ta metoda vključuje velike izgube, saj tehnologija še zdaleč ni popolna. Mehansko metodo pridobivanja zlate rude je nadomestila kemija. Alkimisti in za njimi kemiki so prejeli številne načine za izolacijo želene kovine iz kamnine, med njimi najpogostejše:
- združevanje;
- cianiranje;
- elektroliza.
Elektroliza, ki jo je leta 1896 odkril E. Volville, je postala zelo razširjena v industriji. Njegovo bistvo je v tem, da so anode, sestavljene iz zlatonosne snovi, nameščene v kopalnici z raztopino klorovodikove kisline. Kot katoda se uporablja pločevina iz čistega zlata. Med elektrolizo (prehajanje toka skozi katodo in anodo) se na katodo odloži želena snov in vse nečistoče se oborijo. Tako kemične lastnosti plemenite kovine pomagajo pridobiti jo v industrijskem obsegu skoraj brez izgube.
Zlitine z drugimi kovinami
Zlitine plemenitih kovin so oblikovane za dva namena:
- Spremenite mehanske lastnosti zlata, naredite ga bolj trpežno ali, nasprotno, bolj krhko in kovno.
- Prihranite zaloge plemenitih kovin.
Različni dodatki k zlatu se imenujejo ligature. Barva in lastnosti zlitine so odvisne od kemične formule njenih sestavin. Tako srebro in baker znatno povečata trdoto zlitine, kar omogoča uporabo za izdelavo nakita. Toda svinec, platina, kadmij, bizmut in nekateri drugi kemični elementi naredijo zlitino bolj krhko. Kljub temu se pogosto uporabljajo za izdelavo najdražjega nakita, saj bistveno spremenijo barvo izdelka. Najpogostejše zlitine: 
- zeleno zlato - zlitina 75% zlata, 20% srebra in 5% indija;
- belo zlato je zlitina zlata in platine (v razmerju 47:1) ali zlata, paladija in srebra v razmerju 15:4:1.
- rdeče zlato - zlitina zlata (78%) in aluminija (22%);
- v razmerju 3: 1 (zanimivo je, da bo zlitina v katerem koli drugem razmerju postala bela in te zlitine imenujemo s splošnim izrazom "elektron").
Glede na količino zlata v zlitini določite njegovo čistost. Meri se v ppm in je označena s trimestno številko. Količina želene kovine v vsaki zlitini je strogo urejena s strani države. V Rusiji je uradno sprejetih le 5 vzorcev: 375, 500, 585, 750, 958, 999. Številke vzorcev pomenijo, da je to točno število zlatih mer na 1000 mer zlitine.
Z drugimi besedami, ingot ali izdelek s testno vrednostjo 585 vsebuje 58,5 % zlata. Zlato najvišjega standarda, 999, velja za čisto. Samo kemija ga uporablja za svoje potrebe, saj je ta kovina preveč krhka in mehka. 750 proof je najbolj priljubljen v industriji nakita. Njegove glavne sestavine so srebro, baker, platina. Izdelek mora imeti žig - digitalni znak, ki označuje vzorec.
Zlato je človeštvu poznano že od antičnih časov. Toda v antiki je bil cenjen izključno zaradi videza: nakit, ki se je lesketil kot sonce, je bil simbol bogastva. Šele z razvojem kemije so ljudje spoznali pravo vrednost te mehke kovine in jo trenutno aktivno uporabljajo v panogah, kot so:
- vesoljska industrija;
- letalstvo in ladjedelništvo;
- zdravilo;
- Računalniške tehnologije;
- drugo.
Te industrije imajo zelo visoke zahteve glede lastnosti materiala, ki se v njih uporablja. Pomembnost in prestiž teh območij omogočata, da cena zlata ne le ostane na enaki ravni, ampak tudi počasi leze navzgor. Razlog za te lastnosti je elektronska formula zlata, ki, tako kot pri vseh drugih elementih, določa njegove parametre in zmogljivosti.
Katere je mogoče razlikovati? V zamisli ruskega genija je žlahtna kovina številka 79 in je označena kot Au. Au je okrajšava za latinsko ime Aurum, kar v prevodu pomeni "sijaj". Je v 6. obdobju 11. skupine, v 9. vrsti.
Elektronska formula zlata, ki je razlog za dragocenost - 4f14 5d10 6s1, vse to nakazuje, da imajo atomi zlata pomembno molsko maso, veliko težo in so sami po sebi inertni. Zunanji elektroni takšne strukture vključujejo le 5d106s1.
In ravno inertnost zlata je njegova najdragocenejša lastnost. Zaradi njega je zlato zelo odporno na kisline, skoraj nikoli ne oksidira in je kot oksidant izjemno redko.
Zato sodi v t.i. "Žlahtne" kovine. "Žlahtne" kovine in plini v kemiji so elementi, ki v normalnih pogojih skoraj ne reagirajo z ničemer.
Zlato lahko varno imenujemo najbolj plemenita kovina, saj stoji desno od vseh svojih kolegov v vrsti napetosti.
Kemijske lastnosti zlata in njegova interakcija s kislinami
Prvič, najverjetneje se razpadejo spojine zlata s karkoli drugega kot živo srebro. Živo srebro, ki je v tem primeru izjema, tvori amalgam z zlatom, ki so ga prej uporabljali za izdelavo ogledal.
V drugih primerih so povezave kratkotrajne. Zaradi inertnosti zlata v srednjem veku so alkimisti mislili, da je ta kovina v nekakšnem "idealnem ravnovesju", verjeli so, da ni v interakciji z ničemer.
V 17. stoletju je bila ta ideja uničena, ko so odkrili, da je aqua regia, mešanica klorovodikove in dušikove kisline, sposobna razjedati zlato. Seznam kislin, ki delujejo z zlatom, je naslednji:
- (mešanica 30-35% HCl in 65-70% HNO3), s tvorbo klorovodikove kisline H [AuCl4].
- Selenska kislina(H2SeO4) pri 200 stopinjah.
- Perklorova kislina(HClO4) pri sobni temperaturi, s tvorbo nestabilnih klorovih oksidov in zlatega perklorata III.
Poleg tega zlato sodeluje s halogeni. Najlažji način je, da izvedemo reakcijo s fluorom in klorom. Obstaja HAuCl4 · 3H2O - klorovodikova kislina, ki jo dobimo z izhlapevanjem raztopine zlata v perklorni kislini, potem ko skoznjo prehajajo klorove pare.
Poleg tega se zlato raztopi v klorovi in bromovi vodi, pa tudi v alkoholni raztopini joda. Še vedno ni znano, ali se zlato oksidira s kisikom, ker obstoj zlatih oksidov še ni dokazan.
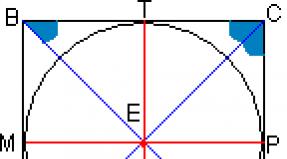
Oksidacijska stanja zlata, njegova vez s halogeni in sodelovanje v spojinah
Standardna oksidacijska stanja zlata so 1, 3, 5. Veliko manj pogosto je -1, to so auridi - običajno spojine z aktivnimi kovinami. Na primer, natrijev avrid NaAu ali cezijev CsAu, ki je polprevodnik. Po sestavi so zelo raznolike. Obstajajo rubidijevi auridi Rb3Au, tetrametilamonijev (CH3) 4NAu in auridi sestave M3OAu, kjer je M kovina.
Še posebej enostavno jih je dobiti z uporabo spojin, kjer zlato deluje kot anion, in pri segrevanju z alkalijskimi kovinami. Največji potencial za elektronske vezi tega elementa se razkrije v reakcijah s halogeni. Na splošno ima zlato kot kemični element z izjemo halogenov izjemno raznolike, a redke vezi.

Najbolj stabilno oksidacijsko stanje je +3, pri danem oksidacijskem stanju zlato tvori najmočnejšo vez z anionom, poleg tega je to oksidacijsko stanje zelo enostavno doseči z uporabo enonabitnih anionov, kot so:
- itd.
Treba je razumeti, da bolj aktiven je anion v tem primeru, lažje se bo vezati z zlatom. Poleg tega obstajajo stabilni kvadratno-planarni kompleksi - ki so oksidanti. Linearni kompleksi z vsebnostjo zlata Au X2, ki so manj stabilni, so tudi oksidanti, zlato v njih pa ima oksidacijsko stanje +1.
Kemiki so dolgo časa verjeli, da je najvišje oksidacijsko stanje zlata +3, pri uporabi kriptonskega difluorida pa je bilo razmeroma nedavno mogoče dobiti zlati fluorid v laboratorijskih pogojih. Ta zelo močan oksidant vsebuje zlato v oksidacijskem stanju +5, njegova molekulska formula pa je videti kot AuF6-.
Hkrati je bilo ugotovljeno, da so spojine zlata +5 stabilne samo s fluorom. Če povzamemo zgoraj, lahko samozavestno poudarjajo zanimivo težnjo k halogenom iz plemenite kovine:
- zlato +1 se odlično počuti v številnih spojinah;
- zlato +3 lahko dobimo tudi s številnimi reakcijami, od katerih večina nekako vključuje halogene;
- zlato +5 je nestabilno, če z njim ni kombiniran najbolj agresiven halogen – fluor.
Poleg tega vez med zlatom in fluorom omogoča doseganje zelo nepričakovanih rezultatov: zlati pentafluorid pri interakciji s prostim atomskim fluorom vodi do tvorbe izjemno nestabilnih AuF VI in VII, to je molekule, sestavljene iz atoma zlata in šest ali celo sedem oksidacijskih atomov ...
Za kovino, ki je nekoč veljala za izjemno inertno, je to zelo netipičen rezultat. AuF6 dismutira v AuF5 oziroma AuF7.
Da bi izzvali reakcijo halogenov z zlatom, je priporočljivo uporabiti zlati prah in ksenonske dihalide v pogojih visoke vlažnosti. Poleg tega kemiki svetujejo izogibanje stiku zlata z jodom in živim srebrom v vsakdanjem življenju.
Ko se reducira iz oksidiranega stanja, se nagiba k tvorbi koloidne raztopine, katerih barva se spreminja glede na odstotek določenih elementov.
Zlato ima pomembno vlogo v beljakovinskih organizmih, zato ga najdemo v organskih spojinah. Primera sta zlati etildibromid in aurotiloglukoza. Prva spojina je molekula zlata, oksidirana s skupnimi napori navadnega etilnega alkohola in broma, v drugem primeru pa zlato sodeluje v strukturi ene od vrst sladkorja.
Poleg tega se pri zdravljenju avtoimunskih bolezni uporabljata Crinazole in Auranofin, ki v svojih molekulah vsebujeta tudi zlato. Številne spojine zlata so strupene in, če se kopičijo v določenih organih, lahko povzročijo patologije.
Kako kemične lastnosti zlata zagotavljajo njegove fizikalne lastnosti?
Zaradi visoke molske mase je briljantna kovina eden najtežjih elementov. Po teži ga prehitevajo le plutonij, platina, iridij, osmij, renij in številni drugi radioaktivni elementi. Toda radioaktivni elementi v snovi mase so na splošno posebni - njihovi atomi so v primerjavi z atomi navadnih elementov velikanski in zelo težki.
Velik polmer, sposobnost tvorbe do 5 kovalentnih vezi in razporeditev elektronov na zadnjih oseh elektronske strukture zagotavljajo naslednje lastnosti kovine:
Plastičnost in duktilnost - vezi atomov te kovine se zlahka pretrgajo na molekularni ravni, hkrati pa se počasi obnavljajo. To pomeni, da se atomi premikajo s pretrganjem vezi na enem mestu in pojavom na drugem. Zahvaljujoč temu je mogoče izdelati zlate žice velikih dolžin in zato obstaja zlati listič.

Izkazalo se je, da ta ali tisti element še vedno prekaša zlato v eni od svojih uporabnih lastnosti. Toda zlato drži svoj pečat prav zato, ker ima kombinacijo pomembnih lastnosti.
Razmerje med kemičnimi lastnostmi zlata in njegovo redkostjo ter rudarskimi značilnostmi
Ta element se v naravi skoraj vedno pojavlja v dveh oblikah: drobci ali skoraj mikroskopska zrna v rudi druge kovine. Hkrati je treba pozabiti na običajen kliše, da se kepec lesketa in na splošno vsaj nekako spominja na ingot. Obstaja več vrst nuggets: elektrum, paladijev zlato, bakrov, bizmut.
In v vseh primerih je pomemben odstotek nečistoč, pa naj gre za srebro, baker, bizmut ali paladij. Naloge z zrni se imenujejo ohlapne. Pridobivanje zlata je zapleten tehnično-kemični postopek, katerega bistvo je ločevanje plemenite kovine od rude, rude ali kamnin s pomočjo združevanja ali uporabe številnih reagentov.
Hkrati se nanaša na razpršene elemente, torej tiste, ki jih ne najdemo v posebej velikih nahajališčih in jih ne najdemo v velikih kosih čistega elementa. To je posledica njegove nizke aktivnosti in stabilnosti nekaterih spojin z njim.