Гиперандрогения яичникового генеза. Надпочечниковая гиперандрогения у женщин: ключевые аспекты заболевания и методы лечения заболевания. Акции и специальные предложения
Патологическое проявление у человека выраженных характерных признаков, присущих противоположному полу, часто провоцирует надпочечниковая гиперандрогения (адреногенитальный синдром). При развитии данного синдрома в организме наблюдается повышенное содержание андрогенов (стероидных мужских половых гормонов), приводящее к вирилизации.
Общие сведения
Вирилизация (маскулинизация) надпочечникового генеза обуславливается чрезмерным продуцированием надпочечниками гормонов андрогенного типа и приводит к внешним и внутренним изменениям, атипичным для пола пациента. Андрогены необходимы в организме взрослой женщины, поскольку отвечают за важные преобразования организма в процессе полового созревания. В частности, они производят синтез эстрогена, а также способствуют укреплению костной ткани, росту мышц, участвуют в регуляции работы печени и почек и формировании репродуктивной системы. Производятся андрогены в основном надпочечниками и в женском организме яичниками, а в мужском, соответственно, яичками. Существенное превышение нормы содержания этих гормонов у женщин способно значительно расстроить репродуктивную систему и даже спровоцировать бесплодие.
Причины возникновения надпочечниковой гиперандрогении
 Гормональный дисбаланс может спровоцировать болезнь.
Гормональный дисбаланс может спровоцировать болезнь.
Основной причиной накапливания в организме андрогенов является врожденный дефект синтеза ферментов, препятствующий преобразованию стероидов. Чаще всего в роли такого дефекта выступает дефицит С21-гидроксилазы, синтезирующей глюкокортикоиды. Кроме того, гормональный дисбаланс бывает последствием влияния гиперплазии коркового слоя надпочечников или опухолевидных образований (некоторые виды опухолей надпочечников способны продуцировать гормоны). Наиболее часто диагностируется наличие надпочечниковой гиперандрогении врожденного типа. Однако иногда встречаются и случаи развития гиперандрогении вследствие опухолей надпочечников, секретирующих андрогены (болезнь Иценко-Кушинга).
Патогенез
Дефицит С21-гидроксилазы способен некоторое время успешно компенсироваться надпочечниками и переходит в декомпенсированную фазу при стрессовых колебаниях гормонального фона, которые создаются эмоциональными потрясениями и изменениями в репродуктивной системе (начало половых отношений, беременность). Когда дефект синтеза ферментов становится выраженным, преобразование андрогенов в глюкокортикоиды прекращается и происходит избыточное накопление их в организме.
Особенности развития адреногенитального синдрома у женщин
Адреногенитальный синдром у женщин приводит к серьезным изменениям в функционировании яичников и нарушениям в репродуктивной системе. Согласно статистическим исследованиям, каждая пятая женщина в той или иной степени страдает гиперандрогенией с различными проявлениями. Причем возраст в данном случае не имеет значения, заболевание проявляется на любом этапе жизненного цикла, начиная с младенчества.
Воздействие гиперандрогении на функцию яичников вызывает следующие проявления:
- угнетение роста и развития фолликулов в ранней фазе фолликулогенеза проявляется аменореей (отсутствием менструаций в течение нескольких циклов);
- замедление роста и развития фолликула и яйцеклетки, не способной к овуляции, способно проявиться ановуляцией (отсутствием овуляции) и олигоменореей (увеличением интервала между менструациями);
- овуляция с дефектным желтым телом, выражается в недостаточности лютеиновой фазы цикла, даже при регулярных менструациях.
Симптомы надпочечниковой гиперандрогении
 Волосяной покров на лице у женщин увеличивается при надпочечниковой гиперандрогении.
Волосяной покров на лице у женщин увеличивается при надпочечниковой гиперандрогении.
Адреногенитальный синдром имеет первостепенные и второстепенные проявления, в зависимости от фазы развития заболевания и факторов его возникновения. Косвенными признаками наличия надпочечниковой гиперандрогении у женщины бывают частые простудные заболевания, склонность к депрессии, повышенная утомляемость.
Основные симптомы надпочечниковой гиперандрогении:
- повышенный рост волосяного покрова (конечности, живот, молочные железы), вплоть до гирсутизма (рост волос на щеках);
- облысение с формированием залысин (алопеция);
- изъяны кожного покрова (угри, прыщи, шелушение и прочие воспаления);
- атрофия мышц, остеопороз.
Второстепенными симптомами адреногенитального синдрома выступают следующие проявления:
- артериальная гипертензия, проявляющаяся в форме приступов;
- повышенный уровень содержания глюкозы в крови (диабет по второму типу);
- быстрый набор избыточного веса, вплоть до ожирения, нуждающегося в терапии;
- промежуточный тип формирования женских половых органов;
- отсутствие менструации или значительные интервалы между менструациями;
- бесплодие или выкидыш (для благополучного протекания беременности необходимо определенное количество женских гормонов в организме, продуцирование которых практически прекращается в случае возникновения гиперандрогении).
Для цитирования:
Пищулин А.А., Карпова Е.А. Овариальная гиперандрогения и метаболический синдром // РМЖ. 2001. №2. С. 93
Эндокринологический научный центр РАМН, Москва
С индром овариальной гиперандрогении неопухолевого генеза или гиперандрогенная дисфункция яичников, называемый ранее синдромом Штейна - Левенталя, в настоящее время, согласно классификации ВОЗ, больше известен в мировой литературе, как синдром поликистозных яичников (СПЯ).
Клиническая картина СПЯ проявляется хроническим ановуляторным состоянием яичников или выраженной гипофункцией желтого тела, что приводит к двустороннему увеличению размеров яичников с утолщением и склерозом белочной оболочки. Эти изменения проявляются нарушением менструальной функции - опсоменореей, аменореей, однако не исключается и развитие метроррагии. Нарушения фолликулогенеза приводят к развитию ановуляторного первичного или вторичного бесплодия.
Одним из основных диагностических критериев СПЯ является гиперандрогенемия - повышение уровня андрогенных стероидов в крови (таких как тестостерон, андростендион), что приводит к развитию гирсутизма и других андрогензависимых дермопатий.
Ожирение или избыточная масса тела часто сопутствуют СПЯ. Определение индекса массы тела (ИМТ) позволяет выявить степень ожирения. Измерение показателей объема талии (ОТ) и бедер (ОБ) и их соотношение указывает на тип ожирения (прогностически неблагоприятным является абдоминальный тип ожирения, при котором ОТ/ОБ > 0,85).
Кроме основных симптомов заболевания, клиническая картина во многом определяется общими обменными нарушениями, такими как дислипидемия, нарушение углеводного обмена, повышенным риском развития гиперпластических и опухолевых процессов со стороны гениталий. Дислипидемия заключается в повышении уровня триглицеридов, холестерина, липопротеидов низкой плотности, липопротеидов очень низкой плотности и снижении липопротеидов высокой плотности. Эти нарушения ведут к риску раннего развития атеросклеротических изменений сосудов, гипертонической болезни и ишемической болезни сердца.
Нарушения углеводного обмена заключаются в развитии комплекса инсулинорезистентность-гиперинсулинемия, что в последнее время является основным направлением в изучении патогенетических звеньев развития СПЯ.
В 60-х годах патогенез СПЯ связывали с первичным ферментативным дефектом овариальной 19-гидроксилазы и/или 3b-дегидрогеназы, объединяя эти нарушения в понятие первичного поликистоза яичников. Однако в работах последующих лет было показано, что ароматазная активность клеток гранулезы является ФСГ зависимой функцией.
Выявленный при СПЯ повышенный уровень лютенизирующего гормона (ЛГ), отсутствие его овуляторного пика, нормальный или сниженный уровень фолликулостимулирующего гормона (ФСГ) при нарушенном соотношении ЛГ/ФСГ (2,5-3) предполагал первичное нарушение гонадотропной регуляции стероидогенеза в овариальной ткани с развитием вторичного поликистоза яичников.
До середины 80-х годов считалось (теория S.S.C. Yen) , что пусковым механизмом в патогенезе СПЯ является избыточный синтез андрогенов надпочечниками в период адренархе в результате измененной чувствительности надпочечников к АКТГ или чрезмерной стимуляции сетчатой зоны коры надпочечников не АКТГ-подобным фактором или под влиянием b-эндорфинов , нейротрансмиттеров, например, дофамина . При достижении критической массы тела (особенно при превышении ее нормы) увеличивается периферическая конверсия андрогенов в эстрогены, прежде всего в печени и жировой ткани . Повышение уровня эстрогенов, в первую очередь эстрона, приводит к гиперсенсибилизации гонадотрофов по отношению к люлиберину (ГнРГ). Одновременно под действием эстрона увеличивается продукция гипоталамусом ГнРГ, повышается амплитуда и частота импульсов его секреции, в результате чего увеличивается продукция аденогипофизом ЛГ, нарушается соотношение ЛГ/ФСГ, возникает относительная недостаточность ФСГ . Усиление влияния ЛГ на яичники способствует повышению продукции андрогенов текальными клетками и их гиперплазии. Относительно низкий уровень ФСГ приводит к снижению активности ФСГ-зависимой ароматазы, и клетки гранулезы теряют способность ароматазировать андрогены в эстрогены. Гиперандрогения препятствует нормальному росту фолликулов и способствует формированию их кистозной атрезии. Отсутствие роста и созревания фолликулов еще более ингибирует секрецию ФСГ. Возросший пул андрогенов в периферических тканях конвертируется в эстрон. Замыкается порочный круг.
Таким образом результатом нарушения центральных и периферических механизмов регуляции стероидогенеза является развитие у больных с СПЯ функциональной овариальной гиперандрогении.
Патогенез СПЯ по S.S.C. Yen представлен на схеме 1:
Схема 1.
В начале 80-х годов ряд авторов предложили новую теорию патогенеза синдрома поликистозных яичников, отличную от теории S.S.C. Yen . Было обнаружено, что СПЯ связан с гиперинсулинемией, и этому синдрому свойственны как нарушение репродуктивной функции, так и метаболических процессов.
На наличие взаимосвязи между гиперинсулинемией и гиперандрогенией указывали еще в 1921 году Achard and Thieris . Они описали гиперандрогению у женщины, страдавшей ожирением и сахарным диабетом 2-го типа и назвали это состояние “диабет бородатых женщин”.
В дальнейшем Д. Барген обнаружил, что у женщин с СПЯ и гиперандрогенией отмечалась базальная и глюкозостимулированная гиперинсулинемия по сравнению с контрольной группой женщин одинакового веса, что предполагало наличие инсулинорезистентности. Выявилась прямая зависимость между уровнями инсулина и андрогенов, и было высказано предположение, что причиной гиперандрогении может быть гиперинсулинемия.
В 1988 году G. Reaven впервые высказал предположение о том, что ИР и компенсаторная гиперинсулинемия (ГИ) играют основную роль в развитии синдрома метаболических нарушений. Он назвал его “синдромом Х” . В настоящее время наиболее часто употребляют термин “метаболический синдром” или “синдром инсулинорезистентности” .
Гипотезы патогенеза гиперинсулинемии и гиперандрогении
Механизм возникновения гиперандрогении и гиперинсулинемии окончательно не изучен. Теоретически возможны три варианта взаимодействия: гиперандрогения (ГА) вызывает ГИ; ГИ приводит к ГА: имеется какой-то третий фактор, ответственный за оба феномена .
1. Предположение о том, что ГА вызывает ГИ основано на следующих фактах. У женщин, которые принимают оральные контрацептивы, содержащие прогестины с “андрогенными свойствами”, выявляется нарушение толерантности к глюкозе. Длительное назначение тестостерона транссексуалам сопровождается возникновением ИР . Показано, что андрогены влияют на состав мышечной ткани, увеличивая количество мышечных волокон второго типа, менее чувствительных к инсулину по сравнению с волокнами первого типа .
2. Большинство факторов свидетельствуют в пользу того, что ГИ приводит к ГА. Было показано, что ИР сохраняется у пациенток, подвергшихся субтотальному или тотальному удалению яичников, а также у женщин, длительно применявших агонисты-ГнРГ, когда отмечалась выраженная супрессия уровня андрогенов . Назначение диазоксида - препарата, подавляющего выделение инсулина поджелудочной железой, вызвало снижение уровня тестостерона (Т) и повышение уровня сексстероидсвязывающего глобулина (СССГ) у пациенток с СПЯ, ожирением и гиперинсулинемией. Внутривенное введение инсулина женщинам с СПЯ приводило к повышению уровня циркулирующих андростендиона и Т. Мероприятия, направленные на повышение чувствительности к инсулину (снижение веса, голодание и низкокалорийная диета), сопровождались понижением уровня андрогенов . Есть данные, что инсулин напрямую может подавлять продукцию СССГ печенью, а в условиях гиперинсулинемии этот эффект усиливается. При этом полагают, что инсулин, а не половые гормоны, является основным регулятором синтеза СССГ. Понижение уровня СССГ приводит к возрастанию концентрации свободного и, следовательно, биологически активного Т (в норме 98% Т находится в связанном состоянии) .
Гипотеза, связывающая ГА с гиперинсулинемией, не дает ответа на вопрос, каким образом яичник сохраняет чувствительность к инсулину при инсулинорезистентном состоянии организма. Было предложено несколько возможных объяснений. Так как инсулин обладает множеством функций, можно предположить селективный дефект некоторых из них. Может наблюдаться органоспецифичность чувствительности к инсулину. Но более вероятно предположение о том, что инсулин действует на яичник не только через рецепторы инсулина, но также через рецепторы инсулиноподобных факторов роста (ИФР) .
Инсулиновые рецепторы и рецепторы ИФР-1 были идентифицированы в яичниках человека (в стромальной ткани яичников здоровых женщин, женщин с СПЯ, в фолликулярной ткани и клетках гранулезы) . Инсулин может связываться с рецепторами ИФР-1, хотя с меньшим сродством, чем с собственными рецепторами. Однако при ГИ, а также в ситуации, когда рецепторы инсулина блокированы или имеется их дефицит, можно ожидать, что инсулин будет связываться с рецепторами ИФР-1 в большей степени .
Возможно, механизмы стимуляции инсулином/ИФР-1 стероидогенеза в яичнике могут быть разделены на неспецифические и специфические. Неспецифические заключаются в классическом действии инсулина на метаболизм глюкозы, аминокислот и синтез ДНК. В результате повышается жизнеспособность клетки и, следовательно, усиливается синтез гормонов . Специфические механизмы включают прямое действие инсулина/ИФР-1 на стероидогенные ферменты, синергизм между инсулином и ЛГ/ФСГ и влияние на количество рецепторов к ЛГ .
Инсулин/ИФР-1, действуя синергично с ФСГ, стимулируют ароматазную активность в культуре клеток гранулезы и тем самым увеличивают синтез эстрадиола. Кроме того, они приводят к повышению концентрации рецепторов ЛГ, усиливая ЛГ-зависимый синтез андростендиона тека- и стромальными клетками.
Возрастающая концентрация андрогенов в яичнике под действием инсулина/ИФР-1 вызывает атрезию фолликулов, что приводит к постепенной элиминации эстроген- и прогестеронпродуцирующих клеток гранулезы, с последующей гиперплазией текальных клеток и лютеинизацией межуточной ткани яичника, которые являются местом продукции андрогенов. Этим объясняется тот факт, что стимуляция яичникового стероидогенеза инсулином проявляется преимущественно в виде гиперандрогении.
Было высказано предположение, что инсулин/ИФР-1 могут стимулировать как ЛГ-зависимую активность цитохрома Р450с17a в яичниках, так и АКТГ-зависимую активность Р450с17a в надпочечниках. Этим, по-видимому, объясняется частое сочетание яичниковой и надпочечниковой форм гиперандрогении у пациенток с СПЯ.
Возможна также взаимосвязь с теорией S.S.C. Yen об участии надпочечникового стероидогенеза в патогенезе СПЯ (схема 2).

Схема 2. Действие инсулина при синдроме поликистозных яичников
V. Insler (1993), проведя исследование уровней инсулина, ИФР-1, гормона роста и их корреляции с уровнями гонадотропинов и андрогенов у женщин с СПЯ, предложил две модели развития данного синдрома. У пациенток с ожирением ГИ вызывает избыточную продукцию андрогенов через рецепторы ИФР-1, которые, действуя в синергизме с ЛГ, вызывают повышение активности цитохрома Р450с17a, основного контролирующего фермента в синтезе андрогенов. У пациенток с нормальной массой тела относительное повышение концентрации гормона роста стимулирует избыточную продукцию ИФР-1. С этого момента синергизм с ЛГ приводит к гиперпродукции андрогенов по тому механизму, что и у пациенток с ожирением. Повышение уровня андрогенов вызывает изменение функции гипоталамических центров, приводя к нарушению секреции гонадотропинов и типичным для СПЯ изменениям (схема 3).
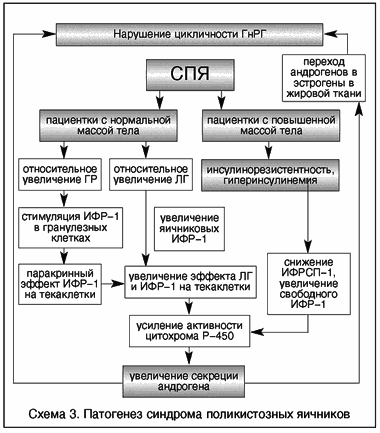
Схема 3. Патогенез синдрома поликистозных яичников
3. Однако имеется ряд хорошо известных состояний ИР, которые не связаны с ГА, например, простое ожирение и СД 2 типа . Для объяснения, почему не у всех пациенток с ожирением и ГИ развивается гиперандрогения и СПЯ, выдвинута гипотеза о существовании генетической предрасположенности к стимулирующему действию инсулина на синтез андрогенов в яичнике . Очевидно, существует ген или группа генов, которые делают яичники женщины с СПЯ более чувствительными к стимуляции инсулином продукции андрогенов .Молекулярные механизмы, приводящие к развитию инсулинорезистентности, до конца не изучены. Однако последние достижения в области молекулярной биологии позволили определить структуру гена, кодирующего рецептор к инсулину у женщин с овариальной гиперандрогенией.
Moller и Flier изучали последовательность аминокислот в структуре ДНК-цепей у больных с овариальной гиперандрогенией. Они обнаружили замещение триптофана на серозин в кодоне 1200. Исследователи предположили, что такое изменение нарушает процесс активации тирозин-киназной системы в рецепторе к инсулину. Низкая активность инсулиновых рецепторов приводит к развитию ИР и компенсаторной ГИ.
Yoshimasa et al. описали другой вариант точечной мутации у больной с гиперандрогенией, инсулинорезистентностью и черным акантозом. Они обнаружили замещение серина на аргинин в тетрамерной структуре инсулинового рецептора. Данная мутация в активном локусе приводила к невозможности соединения a- и b-субъединиц, в результате чего функционально активный рецептор не синтезировался. Приведенные исследования - лишь первые попытки выявления специфической генетической этиологии стромального текоматоза яичников.
Позднее Dunaif A. отмечает, что при синдроме поликистозных яичников ИР может быть обусловлена нарушением аутофосфорилирования b-субъединиц инсулинового рецептора (иР), цитоплазматическая часть которых обладает тирозинкиназной активностью. При этом повышается инсулиннезависимое фосфорилирование остатков серина (СПЯ-ser) с подавлением активности тирозинкиназы (вторичный передатчик сигнала, определяющий чувствительность инсулина к одноименным рецепторам). Данный дефект характерен только для СПЯ-зависимой ИР, при других инсулинорезистентных состояниях (ожирение, ИНСД) эти изменения не выявляются .
Нельзя исключить, что при СПЯ-ser существует некий серинфосфорилирующий фактор. Так, например, выделяют ингибитор серин/треонинфосфатазы, который, по-видимому, и нарушает фосфорилирование иР при СПЯ-ser. Данное соединение схоже с недавно выделенным мембранным гликопротеидом РС-1 (ингибитор тирозинкиназы инсулинового рецептора), но последний не увеличивает инсулиннезависимое фосфорилирование серина иР.
Подобными свойствами обладает и фактор некроза опухоли-a (ФНО-a): фосфорилирование остатков серина IRS-1 (один из вторичных передатчиков сигнала иР) под влиянием ФНО-a влечет за собой подавление тирозинкиназной активности иР.
Moller et al. обнаружили, что фосфорилирование серина Р450с17 человека, ключевого фермента, регулирующего биосинтез надпочечниковых и овариальных андрогенов, повышает 17,20-лиазную активность. Модулирование энзимной активности стероидогенеза за счет фосфорилирования серина было описано для 17b-гидроксистероиддегидрогеназы. Если предположить, что один и тот же фактор (энзим) фосфорилирует серин инсулинового рецептора, вызывая ИР, и серин Р450с17, вызывая гиперандрогению, то тогда можно объяснить взаимосвязь СПЯ и ИР. В экспериментах in vitro было показано, что протеинкиназа А (серин/треонинкиназа) катализирует фосфорилирование серина инсулиновых рецепторов (схема 4).

Схема 4. Ген инсулинорезистентности при СПЯ
Роль лептина при СПЯВ последнее время проводился ряд исследований, посвященных биологической роли лептина, результаты которых обнадеживают. Являясь протеиновым гормоном, лептин влияет на пищевое поведение и оказывает пермиссивное действие в отношении инициации полового созревания у животных. Роль данного гормона в регуляции метаболизма и репродуктивной функции у человека, к сожалению, окончательно не выяснена. По этой причине данные об уровне лептина при овариальной гиперандрогении в сочетании с инсулинорезистентностью и представления о его роли в развитии этих изменений весьма противоречивы.
В последнее время проводился ряд исследований, посвященных биологической роли лептина, результаты которых обнадеживают. Являясь протеиновым гормоном, лептин влияет на пищевое поведение и оказывает пермиссивное действие в отношении инициации полового созревания у животных. Роль данного гормона в регуляции метаболизма и репродуктивной функции у человека, к сожалению, окончательно не выяснена. По этой причине данные об уровне лептина при овариальной гиперандрогении в сочетании с инсулинорезистентностью и представления о его роли в развитии этих изменений весьма противоречивы.Так, согласно результатам исследования, проведенного Brzechffa et al. (1996), значительная часть женщин в популяции с СПЯ имеет уровень лептина выше, чем ожидалось с учетом их ИМТ, свободного тестостерона, чувствительности к инсулину. С другой стороны, последние работы в этой области не показали существенных различий уровней лептина в исследуемых группах при СПЯ и в группах контроля. Кроме того, было установлено, что на содержание лептина не оказывают влияние базальный уровень инсулина, содержание гонадотропинов и половых стероидов. Однако Zachow и Magffin (1997), принимая во внимание данные о наличии мРНК рецепторов лептина в овариальной ткани, продемонстрировали прямое действие указанного гормона на стероидогенез клеток гранулезы крыс in vitro. При этом было показано дозозависимое подавляющее действие лептина на ИФР-1, потенцированное увеличением ФСГ-стимулированного синтеза Е 2 клетками гранулезы. Эти данные подтверждают гипотезу о том, что повышение уровня лептина у лиц с ожирением может противодействовать созреванию доминантного фолликула и овуляции. Весьма интересными являются данные Spicer и Franciso (1997), свидетельствующие о том, что лептин в нарастающих концентрациях (10-300 нг/мл) ингибирует инсулинзависимую продукцию Е 2 и прогестерона в культуре клеток гранулезы. Этот эффект обусловлен наличием специфических сайтов связывания для лептина. По аналогии с этим можно предположить, что высокий уровень лептина может снижать чувствительность у других тканей-мишеней к действию эндогенного инсулина, приводя к развитию ИР при ожирении.
Диагноз
Диагностика синдрома овариальной гиперандрогении при типичной клинической картине не представляет трудностей. Прежде всего это нарушение менструальной функции по типу олиго-, опсо- или аменореи, ановуляция и обусловленное ею первичное или вторичное бесплодие, гирсутизм, угревая сыпь, у 40% больных имеется ожирение различной степени выраженности. При гинекологическом осмотре выявляется двухстороннее увеличение размеров яичников, нередко на фоне гипопластичной матки.
Важное место в диагностике СПЯ занимают гормональные методы исследования , направленные на выявление гиперандрогении, ее источника и определение уровня гонадотропных гормонов: ЛГ и ФСГ. У больных с СПЯ часто встречается преобладание уровня ЛГ над ФСГ, соотношение их нарушено и увеличено (больше 2,5-3). Уровень пролактина нормальный, хотя у 30% больных наблюдается его некоторое повышение.
Уровень экскреции с мочой суммарных 17-КС при СПЯ колеблется в широких пределах и мало информативен. Определение фракций 17-КС (ДГА, 11-окисленных кетостероидов, андростерона, этиохоланолона) также не обеспечивает выявление локализации источника гиперандрогении . Подтверждением овариального источника гиперандрогении является повышение уровня андростендиона (А) и тестостерона (Т) крови и повышение соотношения А/Т. Надпочечниковый генез гиперандрогении подтверждается при повышении уровня дегидроэпиандростерона (ДГА) и его сульфата (ДГА-С) и 17-оксипрогестерона (17-ОН-Р) в крови. Для уточнения локализации источника гиперандрогении предложены различные функциональные тесты, наибольшее распространение из которых получили проба с дексаметазоном, синактеном-депо.
С учетом открытия новых патогенетических звеньев в развитии СПЯ для оценки состояния углеводного обмена необходимо проводить стандартный глюкозо-толерантный тест (75 мл глюкозы per os) с определением уровня глюкозы и иммуно-реактивного инсулина (ИРИ). Свидетельством в пользу инсулинорезистентности являются также ИМТ более 25 и ОТ/ОБ больше 0,85, а также дислипидемия.
Лечение
В основе современного подхода к патогенетическому лечению СПЯ лежит принцип восстановления нарушенной функции яичников
, то есть устранение ановуляции, что в свою очередь приводит к снижению гиперандрогении и восстановлению фоликулогенеза. Однако изучение особенностей этиопатогенеза овариальной гиперандрогении приводит к заключению, что выбор методов адекватного лечения СПЯ оказывается непростой задачей.
Комбинированные оральные контрацептивы - наиболее часто используемая при СПЯ группа препаратов. Механизм действия заключается в подавлении повышенного ЛГ, нормализации соотношения ЛГ/ФСГ, повышении синтеза печенью СССГ. После отмены достигается “ребаунд-эффект”, заключающийся в нормализации гипоталамо-гипофизарной функции, снижении гиперпродукции андрогенов овариальной тканью, нормализации фолликулогенеза и восстановлении овуляции.
Лечение проводится по стандартной схеме: по 1 таблетке в день с 5 по 25 день цикла в течение 3-6 месяцев. При необходимости курсы повторяют. Однако известно, что длительный прием эстроген-гестагенных контрацептивов может привести к гиперинсулинемии, усугубляя тем самым основное патогенетическое звено СПЯ.
Некоторые контрацептивы имеют в своем составе гестагенные компоненты производные 19-норстероидов (норэтистерон, левоноргестрел), обладающих в разной степени андрогенными эффектами, в связи с чем назначение препаратов, содержащих эти компоненты, у больных с гирсутизмом ограничено. Более целесообразно при симптомах гиперандрогении использовать оральные контрацептивы с гестагеном без андрогенного действия.
Возможно применение гестагенных препаратов, лишенных андрогенных свойств в виде монотерапии, особенно при гиперплазии эндометрия. Дидрогестерон назначают по 1 таблетке (10 мг) 2 раза в день с 14-16 по 25 день цикла продолжительностью от 3 до 6 курсов.
Наиболее эффективным средством стимуляции овуляции при СПЯ является антиэстрогенный препарат кломифенцитрат . Основными эффектами антиэстрогенов являются снижение гиперсенсибилизации гипофиза к действию ГнРГ, снижение продукции ЛГ, индукция овуляторного выброса ЛГ, стимуляция овуляции. Препарат назначается по 50 мг, 100 мг в сутки с 5 по 9 день цикла до достижения овуляции по тестам функциональной диагностики, но не более 3-х курсов подряд. В последнее время появились публикации о влиянии кломифенцитрата на систему инсулин-инсулиноподобный фактор роста. В них указывалось, что к 5 дню проводимой стимуляции овуляции кломифеном (150 мг/сут) определялось прогрессивное снижение (максимально на 30%) уровня ИФР-1. Однако в ряде других аналогичных исследований достоверного снижения базального уровня инсулина в ответ на введение кломифена не было обнаружено.
Появление препаратов с антиандрогенными свойствами значительно расширило терапевтические возможности при СПЯ. Наиболее широко применяется препарат Диане-35, содержащий 35 мг этинилэстрадиола и 2 мг ципротерона ацетата. Кроме действия, характерного для оральных контрацептивов, препарат блокирует действие андрогенов на уровне клеток-мишеней, в частности, волосяных фолликулов. Последнее приводит к уменьшению гирсутизма. Препарат применяют по стандартной схеме, как оральный контрацептив курсами по 6 и более циклов. Однако нужно отметить наличие отрицательного эффекта этих препаратов на липидный и углеводный обмены, проявляющегося в повышении уровня холестерина, липопротеидов низкой плотности, а также в увеличении гиперинсулинемии, что требует постоянного динамического контроля за этими показателями у пациенток с СПЯ. Антиандрогенными свойствами обладают также спиронолактон, который широко применяется в лечении андрогензависимых дермопатий.
Одним из основных направлений в современной терапии овариальной гиперандрогении является поиск и применение препаратов и средств, направленных на устранение инсулинорезистентности и компенсаторной гиперинсулинемии.
Прежде всего это мероприятия, обеспечивающие снижение избыточной массы тела: низкокалорийная диета (в пределах 1500-2200 ккал/сут) с ограничением жиров и легко усваиваемых углеводов, ограничение потребления соли до 3-5 г в сутки, занятия умеренной физической нагрузкой, нормализация режима труда и отдыха. Возможно применение препаратов, способствующих снижению ИМТ, например, орлистата, селективно угнетающего желудочно-кишечные липазы (“блокатор жира”) или сибутрамина, блокирующего обратный захват норадреналина и серотонина в синапсах гипоталамического центра “насыщения”. Увеличенный расход энергии (термогенез) также обусловлен синергическим взаимодействием между усиленной функцией норадреналина и серотонина в центральной нервной системе. Это выражается в селективной активации центрального симпатического воздействия на бурую жировую ткань за счет непрямой активации b 3 -адренорецепторов.
Следующим этапом является применение препаратов, улучшающих нарушенную чувствительность тканей к действию инсулина. В литературе имеются данные о снижении гиперандрогении и восстановлении менструальной и овуляторной функции при назначении препаратов ряда бигуанидов (метформин /Сиофор®/, “Берлин-Хеми”). Они потенцируют действие инсулина на рецепторном и пострецепторном уровне и значительно улучшают чувствительность тканей к данному гормону. В некоторых исследованиях показано значительное снижение уровня инсулина натощак и через 2 часа после нагрузки 75 г глюкозы у женщин с СПЯ, применявших метформин. Это снижение коррелировало со снижением уровня андрогенов. Необходимо отметить также, что применение бигуанидов, нормализующих углеводные нарушения, нередко приводит к снижению ИМТ у пациенток с ожирением и положительно влияет на липидный обмен.
В мировой литературе сообщаются результаты применения препаратов, относящихся к классу тиазолидиндионов. Исследования показали, что на фоне лечения троглитазоном (200-400 мг/сут) улучшается чувствительность к инсулину у женщин с СПЯ, снижается уровень андрогенов. Однако выявленное цитотоксическое, гепатотоксическое действие этой группы препаратов ограничивает возможность их широкого применения. Ведется поиск новых препаратов, избирательно влияющих на чувствительность к инсулину.
Несмотря на значительный арсенал различных средств, применяемых для лечения овариальной гиперандрогении, терапия данной патологии должна быть комплексной и последовательной, учитывающей ведущее патогенетическое звено на данном этапе лечения.
Лечение женщин с СПЯ должно быть направлено не только на коррекцию выявленных симптомов этого заболевания, но и на профилактику возможных будущих осложнений. Очень важным является подавление избыточной секреции андрогенов и индуцирование стабильности ежемесячных менструальных кровотечений, что радежно достигается при применении препаратов с антиандрогенными свойствами (Диане-35).
В случае неэффективности консервативной терапии через год можно ставить вопрос об оперативном лечении - лапароскопии с клиновидной резекцией яичников или их лазерной вапоризацией . Эффективность хирургического лечения высокая (до 90-95% восстановления овуляции), а предварительная патогенетическая терапия повышает стабильность достигнутого результата.
Литература:1. Овсянникова Т.В., Демидова И.Ю., Глазкова О.И. Проблемы репродукции, 1998; 6: 5-8.
2. Гинзбург М.М., Козупица Г.С. Проблемы эндокринологии, 1997; 6: 40-2.
3. Старкова Н.Т. Клиническая эндокринология. Руководство для врачей, 1991; 399.
4. Givens J.R., Wiedeme E. B-endorphine and B-lipotropin levels in hirsute women: correlation with body weight. J Clin Endocr Metabol. 1980; 50: 975-81.
5. Aleem F.A., McIntosh T. Elevated plasma levels of f-endorph in a group of women with polycystic ovarian desease. Fertil and Steril. 1984; 42: 686-9.
6. Дедов И.И., Сунцов Ю.И., Кудрякова С.В. Проблемы эндокринологии. 1998; 6: 45-8.
7. Francis S., Greenspan, Forshman P.H. Basic and clinical endocrinology. 1987.
8. Акмаев И.К. Проблемы эндокринологии. 1990; 12-8.
9. Barbieri R.L., Hornstein M.D. Hyperinsulinemia and ovarian hyperandrogenism: cause and effect. Endocrinol Metab Clin North Am. 1988; 17: 685-97.
10. Barbieri R.L., Macris A., Ryan K.J. Insulin stimulates androgen accumulation in incubation of human ovarian stroma and theca. Obstet Gynecol. 1984; 64: 73-80.
11. Barbieri R.L., Ryan K.J. Hyperandrogenism, insulin resistence, acantosis nigricans: a common endocrinopathy with unique pathophysiologic features. Am J Obstet Gynecol. 1983; 147: 90-103.
12. Barbieri R.L., Smith S., Ryan K.J. The role of Hyperinsulinemia in the pathogenesis of ovarian Hyperandrogenism. Fertil and Steril. 1988; 50: 197-210.
13. Stuart C.A., Prince M.J., Peters E.J. Obstet Gynecol. 1987; 69: 921-3.
14. Yen S.S.C. Chronic anovuletion causet by peripheral endocrine disorders. In: Yen S.S.C., Jaffe R.B. Reproductive endocrinology: physiology, pathophysiology, and clinical managment. Philadelphia: Saunders W.B. 1986; 462-87.
15. Moller D.E., Flier J.S. Detection of an alteration in the insulin-reseptor gene in a patient with insulin resistance, acantosis nigricans and polycystic ovarian syndrome. N Engl J Med. 1988; 319: 1526-32.
16. Burgen G.A., Givens J.R. Insulin resistance and hyperandrogenism: clinical syndromes and possible mechanisms. Hemisphera Pablishing CO, Washington, DC. 1988; 293-317.
17. Speroff L., Glass R. H. Clinical gynecologic. Endocrinology and Infertiliti 5 th ed. 1994.
18. Yoshimasa Y., Seino S., et al. Insulin resistance diabetes due to a point mutacion that privents insulin proreceptor processing./ Science. 1988; 240: 784-9.
19. Dunaif A. Endocrin. Rev., 18(6): 1997; 12: 774-800.
Этинилэстрадиол + ципротерона ацетат
Диане-35 (торговое название)
(Shering AG)
Гиперандрогения – это эндокринное заболевание , вызванное усиленной секрецией мужских половых гормонов в организме женщины. Андрогены вырабатываются яичниками и корой надпочечников. В зависимости от первичной причины патологии, могут отличаться клинические симптомы.
Гиперандрогения у женщин вызывает усиленную секрецию лютеинизирующего гормона в гипофизе, что блокирует высвобождение фолликулостимулирующего гормона и эстрадиола. В результате нарушается процесс созревания фолликула, не происходит выход яйцеклетки (ановуляция). Высокий уровень андрогенов способствует образованию множественных кист в яичниках (синдром поликистозных яичников).
Мужские гормоны снижают восприимчивость периферических тканей к инсулину , это приводит к повышению уровня глюкозы в крови, нарушению толерантности к глюкозе, углеводного обмена и развитию сахарного диабета 2 типа.
Классифицируют истинную и идиопатическую гиперандрогению. В первом случае в крови женщины увеличен уровень андрогенов, а во втором повышена чувствительность рецепторов периферических тканей к мужским гормонам.
Причины патологии
Что такое – гиперандрогения и почему она возникает? Основными причинами заболевания являются:
- опухоли, метастазы надпочечников;
- нарушение гипоталамо-гипофизарной регуляции, вызванное травмами, опухолями, воспалительными заболеваниями головного мозга;
- опухоли яичников: лютеома, текома;
- андрогенитальный синдром – врожденная патология коры надпочечников, при которой происходит усиленная выработка тестостерона.

У женщин причины гиперандрогении вызывают нарушение гормонального баланса, функционирования репродуктивной системы, метаболических процессов в организме.
Симптомы яичниковой гиперандрогении
Заболевание бывает яичникового и надпочечникового генеза – в зависимости от органа, который начинает усиленно вырабатывать андрогены. Яичниковая гиперандрогения в большинстве случаев развивается на фоне синдрома поликистозных яичников, реже патологию вызывают гормонпродуцирующие опухоли.
СПКЯ характеризуется нарушением менструального цикла, бесплодием, повышением уровня андрогенов в крови. Фигура девушки изменяется по мужскому типу, начинают расти волосы на лице и теле, увеличивается объем талии, груди, жировая прослойка откладывается в нижней части живота. Нарушается работа сальных желез, появляется себорея, угревая сыпь, которая не поддается лечению. На коже бедер, ягодиц появляются растяжки-стрии. Ночное апноэ (задержка дыхания) приводит к бессоннице.
На фото женщина с характерными признаками гирсутизма.

Характерные симптомы гиперандрогении при СПКЯ – это появление предменструального синдрома. Женщины становятся раздражительными, у них часто меняется настроение, беспокоит мигрень, интенсивные боли внизу живота, набухание, болезненность молочных желез.
Яичники в 2–3 раза увеличиваются в размерах, их капсула утолщается. Внутри органа обнаруживаются множественные кистозные образования. Гормональный дисбаланс вызывает утолщение и гиперплазию эндометрия матки, месячные становятся более продолжительными, обильными, с выделением кровяных сгустков.
Симптомы надпочечниковой гиперандрогении
Такой тип вирилизации развивается на фоне андрогенитального синдрома. Это наследственное заболевание, которое вызывает усиленную секрецию андрогенов в коре надпочечников. Врожденный дефицит ферментов органа до определенного момента компенсируется организмом, но при воздействии ряда факторов происходит нарушение гормонального баланса. Спровоцировать такое состояние может беременность, сильный стресс, начало половой жизни.

Причиной гиперандрогении надпочечникового типа могут быть гормонпродуцирующие опухоли, болезнь Иценко-Кушинга , гиперпролактинемия , акромегалия . Раковые клетки сетчатой зоны коркового слоя вырабатывают «слабые» андрогены. В процессе метаболизма мужские гормоны превращаются в более активную форму и изменяют общий гормональный фон женщины. Ожирение способствует ускорению этих процессов.
Надпочечниковая гиперандрогения вызывает циклические нарушения в яичниках за счет повышения уровня эстрогенов, происходит подавление роста и созревания фолликула, нарушается менструальный цикл, могут вовсе прекратиться месячные. Не происходит процесс овуляции, женщина не может забеременеть и выносить ребенка.

Симптомы гиперандрогении надпочечникового генеза у девочек:
- деформация наружных половых органов при рождении, у ребенка трудно определить пол (женский гермафродитизм);
- задержка полового развития, менархе начинаются в 15–16 лет, менструальный цикл нерегулярный, сопровождается обильной кровопотерей;
- у девочек в подростковом возрасте наблюдаются признаки гирсутизма: растут волосы на лице и теле как у мужчин;
- угревая сыпь, себорея, пигментация кожи;
- частичная атрофия молочных желез;
- увеличение размера клитора;
- алопеция – выпадение волос на голове;
- изменяется фигура: узкие бедра, широкие плечи, низкий рост;
- грубый голос.

У женщин репродуктивного возраста надпочечниковая гиперандрогения приводит к прерыванию беременности на ранних сроках. Это вызвано прекращением роста матки из-за формирования неполноценного желтого тела. У большинства девушек полностью нарушается менструальная и детородная функция, развивается бесплодие, повышается половое влечение. Гирсутизм выражен слабо, телосложение не изменяется, метаболические процессы не нарушены.
Смешанный тип гиперандрогении
Гиперандрогения смешанного генеза проявляется симптомами яичниковой и надпочечниковой формы заболевания. У женщин обнаруживается поликистоз яичников и признаки андрогенитального синдрома.
Проявления смешанного типа заболевания:
- акне;
- стрии;
- повышенное артериальное давление;
- нарушение менструального цикла, аменорея ;
- кисты в яичниках;
- бесплодие, прерывание беременности на ранних сроках;
- нарушение толерантности к глюкозе или высокий уровень сахара в крови;
- повышенное содержание липопротеидов низкой плотности.

Гиперандрогению могут вызывать системные заболевания, которые поражают кору надпочечников, яичники или головной мозг, нарушают метаболизм. Это аденомы гипофиза , нервная анорексия, шизофрения, сахарный диабет 2 типа, акромегалия, пролактинома.
Периферическая и центральная гиперандроегния
При поражении центральной нервной системы, воспалительных, инфекционных заболеваниях или интоксикации организма может подавляться секреция гонадотропных гормонов гипофиза, которые отвечают за выработку лютеинизирующего и фолликулостимулирующего гормона. В результате нарушается процесс созревания фолликула в яичнике и синтез половых гормонов, увеличивается продуцирование андрогенов.
У женщин обнаруживаются симптомы поликистоза , дисфункции яичников, расстройства менструального цикла, кожные высыпания, ПМС.

Периферическая гиперандрогения вызвана повышением активности фермента кожи, сальных желез 5-α-редуктазы, который преобразует тестостерон в более активный андроген дигидротестостерон . Это приводит к гирсутизму различной степени тяжести, появлению вульгарных прыщей.
Гиперандрогения во время беременности
У беременных женщин повышение уровня андрогенов является причиной самопроизвольного прерывания беременности. Наиболее опасные сроки – первые 7–8 и 28–30 недель. У 40% пациенток наблюдается внутриутробная гипоксия плода, чаще всего это происходит в III триместре. Еще одним осложнением является поздний токсикоз, при этом ухудшается работа почек, повышается артериальное давление, появляются отеки тела.
Гиперандрогения при беременности может привести к преждевременному отхождению околоплодных вод, осложненным родам. Изменение гормонального фона негативно сказывается на развитии ребенка, у младенцев может нарушаться мозговое кровообращение, присутствуют признаки внутриутробной гипотрофии.

Гиперандрогения и беременность являются причинами срочного проведения гормональной терапии для предотвращения аборта и других осложнений. Женщинам, у которых ранее случались выкидыши, невынашивание плода, повышение уровня мужских гормонов, необходимо проводить тщательное обследование на этапе планирования беременности.
Диагностика заболевания
Диагноз – гиперандрогения устанавливают по результатам лабораторных исследований на уровень гормонов. При синдроме поликистозных яичников в крови женщины повышается уровень тестостерона, андростендиона , лютеинизирующего гормона. Концентрация ФСГ, пролактина , ДГЭА в крови и 17-КС в моче сохраняется в пределах нормы. Соотношение ЛГ/ФСГ повышено в 3–4 раза. При гормонозависимых опухолях яичников в крови значительно увеличен уровень тестостерона и пролактина.

Смешанная форма заболевания характеризуется незначительным повышением уровня тестостерона, ЛГ, ДГЭА-С в крови и 17-КС в моче. Концентрация пролактина в норме, а эстрадиола и ФСГ снижена. Соотношение ЛГ/ФСГ – 3,2.
Для определения первичной причины гиперандрогении проводят пробы с Дексаметазоном и хорионическим гонадотропином . Положительный результат теста с ХГ подтверждает поликистозное поражение яичников, которое вызывает гормональный дисбаланс. Отрицательный ответ указывает на надпочечниковую природу гиперандрогении.

Тест Абрахама позволяет выявить заболевание надпочечникового генеза, при введении синтетических глюкокортикоидов подавляется синтез АКТГ в передней доле гипофиза, что прекращает стимуляцию коры надпочечников. Если результат положительный, это надпочечниковая гиперандрогения, отрицательный ответ может быть признаком опухоли коркового вещества.
Дополнительно проводят УЗИ яичников для выявления кист, изменения размеров и структуры органа. Электроэнцефалография, МРТ, КТ головного мозга показаны при подозрении на поражение гипофиза.
Методы лечения
Терапию назначают индивидуально для каждой пациентки. Блокаторы рецепторов андрогенов снижают воздействие мужских гормонов на кожу, яичники (Флутамид, Спиронолактон). Ингибиторы секреции андрогенов угнетают выработку тестостерона эндокринными железами (Ципротерона ацетат). Эти средства восстанавливают баланс гормонов, устраняют симптомы патологии.
Гиперандрогения надпочечников компенсируется глюкокортикоидами, которые подавляют избыток андрогенов. Женщинам назначают Дексаметазон, Преднизолон, принимают их и во время беременности, если у будущей матери повышен уровень тестостерона. Особенно важно своевременно лечиться девушкам, у которых есть близкие родственники с врожденным андрогенитальным синдромом. Дозировку и длительность приема лекарства назначает врач.

Гормональное лечение гиперандрогении проводят глюкокортикостероидами, комбинированными оральными контрацептивами (Диане-35), агонистами ГнРГ. Такими препаратами лечится слабовыраженная гиперандрогения яичникового генеза, СПКЯ.
Немедикаментозное лечение
Для восстановления гормонального баланса женщинам рекомендуется регулярно заниматься умеренными физическими нагрузками, отказаться от вредных привычек, вести здоровый образ жизни. Важно придерживаться режима питания, составить сбалансированную диету, исключающую кофе, алкоголь, углеводы, животные жиры. Полезно есть свежие фрукты, овощи, кисломолочные продукты, диетические сорта мяса и рыбы. Для восполнения дефицита витаминов принимают аптечные препараты.

Лечение народными средствами можно проводить только в комплексе с основной терапией. Предварительно следует получить консультацию врача.
Гиперандрогения вызывает нарушения в работе многих и органов и систем, приводит к развитию надпочечниковой и яичниковой недостаточности, бесплодию, сахарному диабету 2 типа. Чтобы предотвратить появление симптомов гирсутизма, кожных высыпаний, метаболического синдрома показано проведение гормональной терапии.
Список литературы
- Козлова В.И., Пухнер А.Ф. Вирусные, хламидийные и микоплазменные заболевания гениталий. Руководство для врачей. Санкт -Петербург 2000.-574 с.
- Невынашивание беременности, инфекция, врожденный иммунитет; Макаров О.В., Бахарева И.В.(Ганковская Л.В., Ганковская О.А., Ковальчук Л.В.)-«ГЭОТАР – Медиа».- Москва.- 73 с.-2007.
- Неотложные состояния в акушерстве и гинекологии: диагностика и лечение. Пирлман М., Тинтиналли Дж. 2008 г. Издательство: Бином. Лаборатория знаний.
- Адамян Л.В. и др. Пороки развития матки и влагалища. – М.: Медицина, 1998.
Гиперандрогения смешанного генеза может проявляться признаками яичниковой и надпочечниковой формы заболевания. Для любой женщины, находящейся в репродуктивном возрасте, одним из самых неприятных заболеваний является . Это заболевание обнаруживается у 4-6% женщин в репродуктивном возрасте. Среди основных причин возникновения этой проблемы следует отметить избыток мужских гормонов и сильные физические нагрузки.
Симптомы гиперандрогении яичникового генеза
К основным симптомам этого заболевания можно отнести косметические проявления – акне, выпадение волос и гирсутизм. Помимо этого, гиперандрогения может иметь и гинекологические проявления. Очень часто женщины, страдающие от данной болезни, имеют нарушение менструального цикла и синдром поликистозных яичников. Еще один неприятный гинекологический симптом – бесплодие. Также стоит отметить, что симптомом данного заболевание может быть ожирение, сахарный диабет, дислипидемия и проявление признаков мужских гормонов. К таким признакам относится:
- рост волос на лице;
- изменение тембра голоса;
- расширение плеч.
Диагностика
Даже слабовыраженная гиперандрогения яичникового генеза поддается диагностике. Поэтому женщинам, столкнувшимся с вышеописанными симптомами, следует непременно обратиться к профильным специалистам. Диагностика этого заболевания обычно основывается на результатах УЗИ, а также данных гормонального и клинического обследования. Больные, страдающие от гиперандрогении яичникового генеза, как правило, имеют повышенный индекс массы тела и гирсутное число 15,2±0,6. Также в процессе диагностического обследования может быть зафиксировано наличие высокой концентрации тестостерона, лютеинизирующего и фолликулостимулирующего гормонов. На УЗИ может проявиться увеличение объема яичников и гиперплазия стромы.
Лечение патологии
Лечение гиперандрогении яичникового генеза должен назначать исключительно профильный специалист. Способ лечения напрямую зависит от целей пациентки. Если она в будущем планирует зачатие детей, то для лечения чаще всего используется кломифен. В том случае, если пациентка не собирается восстанавливать фертильные функции, то лечащий врач, скорее всего, предпишет лечение пероральными контрацептивами. Благодаря этому, у пациентки существенно снизится уровень тестостерона и андростендиона. Альтернативой подобному лечению является прием спиронолактона. Также для лечения этой патологии может быть применен хирургический метод – оперативное удаление яичников.
Слабовыраженная гиперандрогения яичникового генеза, СПКЯ поддаются гормональному лечению глюкокортикостероидами, комбинированными оральными контрацептивами, агонистами ГнРГ.
Что такое Надпочечниковая гиперандрогения
Вирилизация надпочечникового генеза проявляется развитием адреногенитального синдрома (АГС) - в результате врожденной дисфункции коры надпочечников. Это генетически обусловленное заболевание, наследуемое по аутосомно-рецессивному типу. АГС объясняется неполноценностью ферментных систем в железе: у 80- 90% больных неполноценность проявляется дефицитом С21-гидроксилазы.
Патогенез (что происходит?) во время Надпочечниковой гиперандрогения
Основным патогенетическим механизмом АГС является врожденный дефицит фермента С21-гидроксилазы, участвующего в синтезе андрогенов в коре надпочечников. Образование С21-гидроксилазы обеспечивает ген, локализованный в коротком плече одной из 6-й пары хромосомы. Патология может не проявляться при наследовании одного патологического гена и манифестирует при наличии дефектных генов в обоих аутосомах 6-й пары. Частичная блокада синтеза стероидов при врожденном дефиците С21-гидроксилазы увеличивает синтез андрогенов.
До определенного возраста нерезко выраженный дефицит С21-гидроксилазы в надпочечниках компенсируется. При усилении функции надпочечников (эмоциональный стресс, начало половой жизни, беременность) нарушается синтез стероидов в сторону гиперандрогении, что в свою очередь тормозит выделение гонадотропинов и нарушает циклические изменения в яичниках.
При этом в яичниках возможны:
- подавление роста и созревания фолликулов на ранних стадиях фолликулогенеза, приводящее к аменорее;
- торможение роста, созревания фолликула и яйцеклетки, не способной овулировать, что проявляется ановуляцией и олигоменореей;
- овуляция с неполноценным желтым телом: несмотря на регулярные менструации, имеется недостаточность лютеиновой фазы цикла.
При всех этих вариантах гипофункции яичников возникает бесплодие. Частота невынашивания беременности при АГС достигает 26%.
Симптомы Надпочечниковой гиперандрогения
В зависимости от выраженности дефицита С21-гидроксилазы и соответственно гиперандрогении выделяют классическую форму АГС и легкие, или поздние (пубертатную и постпубертатную), формы АГС.
Классическая форма АГС сопровождается врожденной гиперплазией надпочечников. Такая вирилизация приводит к патологии наружных половых органов (ложный женский гермафродитизм) и неправильному определению пола при рождении. Детям с такой патологией проводят хирургическую коррекцию иола, дальнейшее лечение и наблюдение обеспечивает детский эндокринолог.
В пубертатном периоде основными жалобами больных являются гирсутизм, угревая сыпь, нерегулярные менструации. Менархе наступает в 15-16 лет, в дальнейшем менструации нерегулярные, есть тенденция к олигоменорее. В этом периоде более выражен гирсутизм: рост волос по белой линии живота, на верхней губе, внутренней поверхности бедер. Кожа жирная, пористая, с множественными акне, обширными пятнами гиперпигментации. В телосложении также заметно влияние андрогенов: нерезко выраженные мужские черты с широкими плечами и узким тазом, укорочение конечностей, невысокой рост. После появления гирсутизма молочные железы гипоплазированы.
У пациенток с иостпубертатной формой АГС нарушены менструальная и репродуктивная функции. Постпубертатная форма АГС манифестирует прерыванием беременности на раннем сроке. Выраженность нарушений репродуктивной функции зависит от степени дефицита С21-гидроксилазы: от снижения репродуктивной функции вследствие ановуляторных циклов до невынашивания беременности из-за формирования неполноценного желтого тела. Гирсутизм выражен незначительно: скудное оволосение белой линии живота, отдельные волоски над верхней губой. Телосложение женского типа, молочные железы достаточно развиты, метаболические нарушения нетипичны.
Диагностика Надпочечниковой гиперандрогения
При расспросе выявляют нарушения менструального цикла у сестер и родственниц пациентки по материнской и отцовской линии. При АГС рано и быстро развивается чрезмерное половое оволосение, поздно наступает менархе и в дальнейшем менструации нерегулярные.
Для АГС патогномоничны спортивное телосложение, гипертрихоз, угревая сыпь, умеренная гипоплазия молочных желез. АГС не сопровождается повышением массы тела в отличие от других эндокринных нарушений с гипертрихозом.
Основная роль в диагностике АГС принадлежит гормональным исследованиям. Для уточнения происхождения андрогенов проводят гормональные исследования до и после дексаметазоновой пробы. Снижение уровней 17-КС в моче, тестостерона и дегидроэпиандростерона в крови после приема препаратов, тормозящих выделение АКТГ, указывает на надпочечниковое происхождение андрогенов.
Диагностика постпубертатного АГС основана на:
- гипертрихозе и снижении репродуктивной функции у сестер пациентки по материнской и отцовской линии;
- позднем менархе (14-16 лет);
- гипертрихозе и нерегулярных менструациях с периода менархе;
- вирильных чертах морфотипа;
- повышении содержания 17-КС в моче, тестостерона и дегидроэпиандростерона в крови и снижение их уровня до нормы после приема дексаметазона.
Данные УЗИ яичников свидетельствуют об ановуляции: фолликулы различной зрелости не достигают преовуляторных размеров. Базальная температура с растянутой первой и укороченной второй фазой свидетельствует о недостаточности желтого тела, тип влагалищных мазков андрогенный.
Лечение Надпочечниковой гиперандрогения
Выбор лечебных препаратов у больных с АГС определяется целью терапии: нормализацией менструального цикла, стимуляцией овуляции, подавлением гипертрихоза.
С целью коррекции нарушений гормональной функции коры надпочечников используют глюкокортикостероидные препараты. Дозу дексаметазона определяют в соответствии с уровнем содержания 17-КС в моче, дегидроэпиандростерона и тестостерона в крови (на фоне лечения уровень этих гормонов не должен превышать верхнюю границу нормы). Эффективность лечения, кроме гормональных исследований, контролируют путем измерения базальной температуры и наблюдения за менструальным циклом. При неполноценной второй фазе менструального цикла необходима стимуляция овуляции с 5-го по 9-й день, на фоне которой часто наступает беременность. Во избежание самопроизвольного выкидыша терапию глюкокортикостероидами следует продолжить, ее длительность определяют индивидуально.
Если женщина не заинтересована в беременности, а основной жалобой являются гипертрихоз и гнойничковые высыпания на коже, рекомендуются препараты, содержащие эстрогены и антиандрогены. На гипертрихоз эффективно влияет диане, особенно в сочетании с андрокуром в первые 10-12 дней. Диане назначают с 5-го по 25-й день менструального цикла в течение 4-6 мес.
Антиандрогенный эффект дает верошпирон, в результате подавления образования дигидротестостерона из тестостерона в коже, волосяных фолликулах и сальных железах. Верошпирон назначают по 25 мг 2 раза в день. Применение верошпирона в течение 4-6 мес снижает на 80% уровень тестостерона, но снижения уровня кортикотропного и гонадотропных гормонов не отмечено.
Применение синтетических прогестинов также уменьшает гипертрихоз, но использование этих препаратов у женщин с АГС не должно быть длительным, так как подавление гонадотропинов нежелательно при угнетенной функции яичников.
К каким докторам следует обращаться если у Вас Надпочечниковая гиперандрогения
Гинеколог
Акции и специальные предложения
Медицинские новости
12, 13 и 14 октября, в России проходит масштабная социальная акция по бесплатной проверке свертываемости крови - «День МНО». Акция приурочена к Всемирному дню борьбы с тромбозами.
07.05.2019
Заболеваемость менингококковой инфекцией в РФ за 2018 г. (в сравнении с 2017 г.) выросла на 10 % (1). Один из распространенных способов профилактики инфекционных заболеваний - вакцинация. Современные конъюгированные вакцины направлены на предупреждение возникновения менингококковой инфекции и менингококкового менингита у детей (даже самого раннего возраста), подростков и взрослых.
25.04.2019
Грядут долгие выходные, и, многие россияне поедут отдыхать за город. Не лишним будет знать, как защитить себя от укусов клещей. Температурный режим в мае способствует активизации опасных насекомых...
Вирусы не только витают в воздухе, но и могут попадать на поручни, сидения и другие поверхности, при этом сохраняя свою активность. Поэтому в поездках или общественных местах желательно не только исключить общение с окружающими людьми, но и избегать...
Вернуть хорошее зрение и навсегда распрощаться с очками и контактными линзами - мечта многих людей. Сейчас её можно сделать реальностью быстро и безопасно. Новые возможности лазерной коррекции зрения открывает полностью бесконтактная методика Фемто-ЛАСИК.