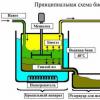
Mikroskoopia mikroskoopia valmistamismeetodid. Mikroskoopiline labor. a) moodustas kaare
Mitte kõik, mis on käepärast, on mõistlik panna objekti tabelisse ja proovige kaaluda mikroskoobi okulaari. Näiteks ei pea läbipaistmatu objektid (sõrm, münt) üldse kaaluda ja kaaluma üsna tugevat suurendusklaasi.
Tavaliselt kasutatakse mikroskoobide jaoks spetsiaalselt ettevalmistatud mikroskoobid. Mikrodaparatsiooni valmistamisel võetakse teema klaas (suurus 25 × 75 mm), mis asetatakse kõnealune objekt; Tavaliselt on parema ohutuse ja kasutusmugavuse jaoks kaetud õhukese katteklaasiga (suurus 18 × 18 mm).
Meetodit kasutades toiduvalmistamise ja ladustamise ajal eristada:
- alalised ravimid - objekt asetatakse läbipaistvatesse kangestumisse keskkonda (tavaliselt Kanada Balm) ja kate katteklaasiga; Selliseid ravimeid saab ladustada aastaid ja aastakümneid, kuid nende ettevalmistamine on üsna töömahukas (objekt tuleb hoolikalt valmistada: veetustatud, värvitud jne);
- ajutised ravimid - objekt asetatakse vedelasse söötmesse (vesi, soolalala, glütseriin-želatiin jne), sellised ravimid sobivad kasutamiseks mitu tundi, kuid eksperimente saab nendega läbi viia (näiteks vesi asendamiseks a soolalahust kindlal kontsentratsioonil, add värvainega jne.).
Alaline ravim |
Tabelis on näidatud valmististe liigid sõltuvalt uuringu objekti olemusest.
Kirjeldus |
Alaline / ajutine |
Näide |
||
Kogu ettevalmistamine |
Kogu organism või selle väikesed osad (jäsemed, suukaudne aparaat). Tavaliselt nõuavad töötlemist (selgitus) |
Alaline, ajutine |
||
Objekt valatakse plastmaterjali (parafiin, akrüül) ja pärast selle tahkestamist lõigatakse see mikrotoomiga õhukestesse plaatidesse (õhukeste osade tootmiseks) |
Tavaliselt seisab |
|||
Praegune kihi preparaat ilma klaasist katmata (tavaliselt veresaadus): poleeritud klaasiga klaasiga tilk, kuivatatud klaasist õhukese kihi pinna üle |
Ajutine, harvem |
|||
Õhuke (paksus 0,03-0,02 mm) plaat kivi või muu tahke proovi (luu, fossiil), liimitud katteklaasi |
Püsiv |
Mõnel juhul saab ajutist ettevalmistust vaadata otse katteklaasi katmata. See ravim on peaaegu võimatu kaaluda järsult kõik - mõned osad on fookuses ja ülejäänud ei ole. Aga kui me kaalume sellist ravimit mikroskoobi väikese suurenemisega, saate kaaluda mõningaid huvitavaid objekte.
Ka avatud aja kujul on võimalik kasvatada erinevate soolade (atsetüülsalitsüülhappe või aspiriiniga) kristalle; vasksulfaat või vasksulfaat; punased veresoolad või kaaliumhinaanoferraat). Vähesed tilgad veepõhise või alkoholi soolalahuse kantakse sõrmepuhastatud tolmu ja sõrmejäljed (parema kvaliteediga kristallid, lahus on eel-kõrge, sest see vähendab arvu kristallimispunktide ja saada suuremaid ja puhas kristallid). Tilkide lastakse kuivada (see on võimalik katsetada ühe klaasiga, kuumutada selle, et kiirendada aurustamist ja teine \u200b\u200blahusti aurustamiseks ja kristallid langevad iseseisvalt). Võite kaaluda ka poolvalmis mikro-protsessi kristallisatsiooniprotsessis: näete, kuidas kristall suureneb otse silmis või kuidas vedeliku voolu tekib tahke embrüo ümber ioonide kontsentratsioonide erinevuse tõttu.
Lihtne ja tähelepanuväärne viis mikrofreetide tegemiseks ilma kärbeteta, võimaldades kaaluda uuritava objekti pinna leevendamist (näiteks taimede, putukate kehade leht) - meetod replica. Samal ajal võetakse objekt (näiteks taime leht) ja selle jaoks kasutatakse õhukese läbipaistva küünelakk (piisavalt väikesed laigud 5 × 10 mm). Pärast laki kuivab (umbes 5-7 minutit), tükk kleepuv lint liimitud laki plekk; Nii et replica eraldatakse, seejärel asetatakse see slaidile ja vaadatakse mikroskoobi all.
1.1. Ajutise ettevalmistuse ettevalmistamine
Ajutise ravimi valmistamise tehnikat on kooli katsete korral tuntud vööri nahaga. Paneme klaasklaasi lauale (ravimid hoitakse alati subjekti külje nägu taga). Klaasi keskel paneme 1-2 tilka vett ja uuringu objekt võtke kaaneklaas külgselgele küljele ja katke need hoolikalt objektiga tilk üle. Õige on korrigeerida ühe nägu katteklaasi katteklaasi ja vähendada aeglaselt klaaside vahelist nurka, et katta tilk objektiga. See vähendab õhumullide võimalust.
1.2. Toiduvalmistamise vere määrdumine
Verekatse vereanalüüsi valmistatakse järgmiselt.
| Samm | Kirjeldus |
Foto |
Asetage väikese vere tilk joondamise klaasi horisontaalsele pinnale, klaasist kapillaarpipettiga (või otse sõrmepunktist, edastage vere langus verd steriilse slaidi klaasi lõpuni, püüdes klaasi puudutada torgatud nahk). |
||
Puhas lihvklaas asetatakse lühikese servaga 45 ° nurga all olevale klaasile tilk. Ootame, kuni veri on klaasi serva hägune. |
||
Niipea, kui vere levimine üle serva, nad veedavad kiire liikumise tilk mööda objekti klaasi. Seda ei tohiks klaasile tugevalt pressitud, kuna veri ühtsed elemendid võivad kokkuvarisema. |
||
Pärast keetmist kuivatatakse niiske õhus kiiresti, kuni märg läige on kadunud, hoides seda lambi lambi lambi üle lambi või selle õhku. Hästi valmistatud õhukese määrdumise korral on kollakas värv ja lõpeb "pitsiniga". Pink ja punakas löögid ei sobi, kuna need on liiga paksud ja rakkude elemendid on raske eristada. |
Pilte ja kirjeldus Microtome.info/documents/micropreparaty.html.
2. Mikroskoputuse mõned funktsioonid
Mikroskoopide kasutamine väikese ja suure suurendusega on kooli katsete osas üsna tuntud ja ei vaja eriti keerulisi oskusi.
2.1. Mmimonaliobjektiiv
Kui keelekümblusmikroskoobi on keelekümblusiooniläätsega (see on tähistatud 100 × mi ja musta tsükliga ja millel on liikuv osa objektiivi mikroparaadile), siis on teil võimalus kaaluda suure kasvuga objekte (aga See on mõttekas kasutada lööki).
Naftakümbluse objektiivi töötamise kord on järgmine.
- Välja kuiv objektiivi kiirte (keerake läätsed trumli nii, et ükski objektiiv ei pöörata ravimi).
- Ravimi puhul kohaldage ühte tilk sukeldumisõli; Eelistatavalt on keelekümblusõli ka vähe määrib objektiivi selle objektiivi.
- Läätsede trumli keeramine sisestage sukeldamislülituskiirele (enne fikseerimise klõpsamist).
- Langetage objektiiv, et kokku puutuda em mõõtmega õli tilka, siis vaadates mikroskoobi, jäme ja peene fookuskruvidega, seadistage teravus.
Töötades keelekümbluse objektiiv, maksimaalse valgustatuse ei nõuta. Pärast uuringu lõppu tuleb sukeldamistobjektiiv pühkida pehme optilise lapiga või PVT-ga, mis on kergelt niisutatud spetsiaalse vedelikuga optika puhastamiseks. NB tahes muud liiki objektiive ei saa pühkida!
Teiste õli vedelike seederõli asemel ei ole soovitatav, sest kui kasutatava keelekümbluse murdumisnäitaja (näiteks vaseliinõli näitajaga 1,48162) erineb seederõli murdumisnäitajast (indikaator 1.515) on võimalik vähendada Seevastu ähmasus pildi vähenes resolutsioon.
2.2. Fotod palmikvalgustuse ja pimedas valdkonnas
Puistepreparaatide jaoks (kokku ravimite putukad, vetikad jne) on huvitav kasutada muid valgustust kui tavaline poolläbipaistv. Valgustuse reguleerimiseks mikroskoobides kasutatakse kondensaatorit - pöörleva seadme erinevate läbimõõdude ja asukoha aukudega. Eriliste võimaluste kasutamine kondenseerimiseks saate muuta ravimi valgustuse olemust, rõhutades vaatlusaluse objekti mahtu.
Tabelis võrdleb töö valgustus eri tüüpi.
Valgustuse tüüp |
Loomise meetod |
Vaade objektiivi õpilast echolariga |
Näide |
|
Normaalne (poolläbipaistev) |
Light läbib vaatevälja ühtlaselt. |
|||
1) ajutised ettevalmistused
Et õppida taimseid objekte kerge mikroskoobiga, peate valmistama mikroprotsessi. Mikropreparaate, mis ei ole mõeldud pikaajaliseks ladustamiseks nimetatakse ajutiseks. Uuritud objekti asetatakse slaidile vee tilk vett, glütserool, lahuse, reagendi või värvi ja kaetud katteklaasiga. Selliseid ravimeid saab hoida mitu päeva, asetades märg atmosfääri.
2) alalised ravimid
Püsivad uimastite valmistatakse spetsiaalsete tehnikate jaoks, mis tagavad nende ladustamise aastakümneid. Pidev ettevalmistused hõlmavad lööki, ravimeid ja sektsiooni. Brokese kasutatakse uuring vereliblede, põllukultuuride mikroorganismide, isoleeritud koerakkude. Kogupreparaadid on eraldi läbipaistvad ja õhukesed objektid. Koolitusosad saab teha raseerija abil käsitsi. Siiski on kõrgekvaliteedilised osad, mille paksus on 10 ... 22 mikromeetrit, kasutatakse tavaliselt spetsiaalsete seadmetega - mikrotomite abil. Selliseid sektsioone nimetatakse sageli mikrotomite ravimitena. Peenede kärpete jaoks (0,01 ... 0,05 um või 10 ... 50 nanomeetrit) kasutage ultramicrothomesi.
Püsivate ravimite ettevalmistamise peamised etapid peavad lühidalt.
1. Materjali fikseerimine. Vahetult pärast fikseerimist, pestes materjalis või veega (pärast vee lukud) või80% alkoholi (alkoholi lukud). Vedelike muutuste arv - vähemalt 3. Aeg - kuni 24 tundi.
2. Dehüdratsioon alkoholides kasvava kontsentratsiooni. Paralleelselt esineb materjali tihend. Materjali järjestikune liikumine mitmete lahenduste kaudu nimetatakse juhtmestamiseks. Pärast vesiklambrid kasutatakse 8 alkoholi nihket: 20%, 40%, 80%, kaks vahetust 96%, kaks 100% vahetust. Pärast alkoholi lukud - 4 alkoholi nihkub: kaks vahetust 96% ja kaks vahetust 100%. Iga vahetuse, kui materjal on hoiti 1 tund.
3. Valgustatuse. See immutab materjali parafiin-ksüleenlahustiga (benseen, kloroform). Proov asetatakse igale järgnevale lahendusele 1 tunni seerias: 3 osa alkoholi + 1 osa ksüleenist, seejärel 2 osa alkoholi + 2 osa ksüleenist, seejärel 1 osa ksüleenosade alkoholist + 3; Siis kaks ksüleeni vahetust.
4. Parafiinile valamine. See on ksüleen parafiini asendamine. Proov asetatakse ksüleeni ja parafiini segusse temperatuuril 55 ... 57 kraadi ja lahkuge sellel temperatuuril termostaadis, et täielikult aurustada ksüleen (mitu tundi kuni mitu päeva). Siis temperatuuril 55 ... 57 kraadi, juhtmestik parafiin I (6 ... 12 tundi), parafiin II (6 ... 12 tundi) ja valades parafiin III. Paraffiinid I, II, III erinevad ainult puhtuses: parafiin III on lõppkeskkond, millel peaks olema suurim puhtus. Selle tulemusena saadakse parafiiniplokid, milles materjali proovid sõlmitakse. Neid plokke saab lõigata mis tahes suunas.
5. Värvimisosad. Parafiinilõikudel liimitakse puhta klaasi. Liimina võib antiseptilise (tümoli või fenooli lisamisega kasutada glütserooliga kanamunavalgu segu (suhe 1: 2). Tavaliselt toodavad sektsioonide dewaxing. Selleks viiakse krübitud lõikamistega klaas läbi ksüleeni, vähendava kontsentratsioonialkoholide (100%, 96%, 80%, 70%) ja destilleeritud veega. Öeldes aega igas keskkonnas - 2 ... 3 minutit. Järgmine on värvitud vastavalt meetoditele.
6. Dehüdratsioon ja värvitud kärpete valgustamine. Seda tehakse juhtmestiku kaudu kontsentratsiooni suureneva alkoholide kaudu ja seejärel ksüleeni kaudu.
7. Kokkuvõte Kolmapäeval (valamine). Narkootikumide pikaajalise säilitamise puhul tuleb nad sõlmida kolmapäeval, kaitstes ravimit õhu oksüdatsiooni ja seente kahjustamise eest. Spetsiaalsed vaigud kasutatakse täitmiseks (Kanada Balm, Fir Balsam), mis lahustatakse ksüleenis vedela mesi järjepidevuse suhtes. Sellise lahuse tilk kantakse katteklaasiga lõigatud ja kate suhtes.
6. Rakulise keemiline koostis. Micro ja macroelements.
Raku koostises avastati enam kui 80 keemilist elementi, samas kui ainult rangeid elemente iseloomulik ainult elusorganismide ei tuvastatud. Kuid ainult seoses 27 punkti puhul on teada, millised ülesanded nad täidavad. Ülejäänud 53 elemendid jäävad tõenäoliselt kehasse väliskeskkonnast.
1. Macroelements
Need moodustavad suurema osa raku ainest. Nad moodustavad umbes 99% kogu raku massist. Eriti kõrge nelja elemendi kontsentratsioon: hapnikku (65-75%), süsiniku (15-18%), lämmastik (1,5-3%) ja vesinik (8-10%). Macrolements hõlmab ka elemente, mille sisu rakus arvutatakse kümnendiku ja protsendiga. See on näiteks kaalium, magneesium, fosfor, väävli, raud, kloor, naatrium.
2. mikroelements nende hulka peamiselt aatomite metallide, mis on osa ensüümide, hormoonide ja
muud elutähtsad ained. Kehas need elemendid sisalduvad väga väikestes kogustes: 0,001 kuni 0,000001%; Seal on nende elementide seas bor, koobalt, vask, molübdeen, tsink, jood, broom jne
3. Ultramicroelements
Nende kontsentratsioon ei ületa 0,000001%. Nende hulka kuuluvad uraan, raadium, kuld, elavhõbe, berüllium, tseesium ja muud haruldased elemendid. Enamiku nende elementide füsioloogiline roll taimede, loomade, seente ja bakterite organismides ei ole veel loodud.
Venemaa Föderatsiooni Haridus- ja Teadusministeerium
Riikliku haridusasutuse kõrgema professionaalse hariduse
"Shadrin State Pedagoogika Instituut"
Loodusteaduste osakond õpetamismeetodiga
Mikrofrantide valmistamise meetodid bioloogiast
Kursuse töö
eriala 050102 "Bioloogia"
Teadja:
Gorshkova Ekaterina Andreatna
Student 3 kursuse päeva osakond
Teadusnõunik:
Bioloogiliste teaduste kandidaat, dotsent
Sharypova Nadezhda Vladimirovna
_________________________________
Hindamine __________________________
ShadrinSsk
2014
Sissejuhatus ....................................................... ....................................... .3.
§ 1. Mikropepeedide omadused ja nende kasutamine ........................ 4
§ 2. Micro-remondi valmistamiseks vajalikud seadmed ......7
§ 3. Materjali ettevalmistamine mikro-remondi ettevalmistamiseks ............ ... 12
§ 4. Mikro-remondi valmistamise meetodid ........................................ .17
Kokkuvõte ................................................. .................................... 31.
Bibliograafiline nimekiri .................................................... ............ .32
Lisa ..................................................... ............................................... ... 34
Sissejuhatus
Teadusuuringute teema asjakohasus. Mikro töötlemine on visuaalse õppevahend ja seetõttu kasutatakse seega laialdaselt bioloogia õppetundidel laboratoorsete klasside ajal uue materjali, üldistuste, võrdluste ja uuringute uurimisel.
Bioloogia kabinetite ebapiisava sätte tõttu valmis mikroparandus, mis on vajalikud teema paremaks uurimiseks, saab neid teha iseseisvalt.
Põhineb asjakohasuse põhjal valisime järgmised uurimissuume: "Bioloogia mikrosaratsioonide valmistamise meetodid".
Objekti uuringud on mikromõõtmed.
Asi - mikrokrandide valmistamismeetodid.
Uuringu eesmärk: Uurida bioloogiat ja nende valmistamismeetodeid mikropreparaatide tüüpe.
Teadusülesanded:
- Uurige ja analüüsige selle teema kirjandust.
- Tehke omadus mikrokracy ja näpunäiteid nende kasutamise bioloogia õppetunde.
- Kirjeldage mikrotöötlemise valmistamiseks vajalikke seadmeid.
- Õpi valmistama materjali mikrokrandide valmistamiseks.
- Uurige mikrokraatsete seadmete meetodeid.
Eesmärkide ja ülesannete rakendamiseks kasutasid järgmisiuurimismeetodid: Teadus- ja metoodilise kirjanduse analüüs teadusuuringute teemal, piloototsingu ja selle tulemuste kokkuvõtmine.
Kursuste struktuur. Kursuse töö koosneb sissejuhatusest, 4 lõigetest ja vangistusest, bibliograafilise nimekirja esitatakse, sealhulgas 16 allikat, 1 taotlust.
§ 1. Mikropreparatsiooni omadused ja nende kasutamine
Loomulik hajutatud hüvitiste hulka kuuluvad herbaarium, märgpreparaadid, mikrosihvid.
Mikrotoode on õhukese eluorganismi või mikrolaarse õhukese sektsiooni, mis on ümbritsetud läbipaistvale palsamile (keelekümblusõli) või kuivatatud kahe klaasi (objekti ja katte) vahel.
Mikrotöötlemise päritolu pärineb elevandiluu või tavalise luu kasutamisest kui läbipaistva vilgulite plaatide vahel asetatud proovide seista. Sarnane disain oli populaarne Victorian Inglismaal, samas kui kuninglik mikroskoopiline ühiskond esitas standardiseeritud klaasmikroskoobi klaasi.
Mikro töötlemine võimaldab näidata organismide sisemise raku struktuuri, mis aitab õpilastelt teadmisi organismide ühe raku struktuuri kohta. Micro-töötlemist saab jagada kahte rühma:
- püsiv toodetud tehas spetsiaalselt koolituseks;
- ajutine, valmis õpetaja õppetund või õppetund koolilapsed ühekordne.
Püsivad MicrosPerraadid on organismide, nende elundite kudede parimad osad. Enamikku rakkudest ei ole värvitud ja seetõttu isegi suure kasv mikroskoobi, on raske kaaluda rakusiseseid struktuure, kaasa arvatud kernel. Sellega seoses värvitakse rakkude mikroseadmeid spetsiaalsete värvidega, et anda neile suurema selguse. Õpetajad peavad tingimata vaja hoiatada lapsi, et värv ei ole mikrostruktuuride jaoks loomulik. Kasutage neid uurides uut materjali, üldistusi, võrdlusi ja uuringud.
Ajutised ettevalmistused on nn, sest neid ei salvestata pikka aega. Pärast tutvumine microwieth, ajutise preparaadi pestakse maha slaidi klaasist. Mikroprotsessi ettevalmistamine on üks bioloogia käigus moodustunud oskuste kohustuslikku tüüpi oskusi, alates 6. klassist.
Mikroorganismide elusrakkude uurimiseks kasutatakse narkootikume "purustatud tilk", "rippuv tilk", "jäljend", "agarearfilm" ("mikrokultuur"). Alive rakupreparaadid vaadatakse "kuivsüsteemide" mikroskoobiga. Ettevalmistused, tööga, mis on juba lõpetatud enne pesemist, hoitakse desinfektsioonivahendavas lahuses.
MICROSPSS võimaldab bioloogia kooliprogrammi programmi jaoks laia valikut eksperimente. Need on mõeldud mikroskoopiliste struktuuride üksikasjalikuks uurimiseks mikroskoobi all.
Õpetaja töötada mikro-protsessi peab selgelt selgitama õpilasi, et nad peaksid nägema tabelite, jooniste, diagrammide jne.
Uuringuga õpetajad kasutavad sageli "loll", (ilma siltideta) microspections. Üliõpilastele antakse ülesanne määratleda microSerrats, rääkige ühe või teise koe struktuurist. Soovitatav on salvestada sama mikropaketti ühes pakendis, nii et saate neid kiiresti õpilastele levitada.
Mikromeside salvestatakse kütteseadmetest eemale ja nii et slaidiklaas on horisontaalasendis, et vältida mikroprotsessi "libistamist".
Mikrotöötlemise nõuded:
- Prillid peaksid olema värvitu ja läbipaistev. Kaetud klaas peaks olema õhem kui teema, mis toimib toote aluseks.
- Mikro-ravi peab olema tsentreeritud, st. Asub kaaneklaasi keskel. Väga väikese objekti asukoht peab olema märgitud raamiga.
- Mikroskoopilised osad peaksid olema väga peened ja neil on kõik uurimiseks vajalikud elemendid.
- Eraldi mikroperature kangad peavad olema värvitud helge vastupidava värviga.
- Mikro-remont tuleb valmistada iga bioloogia kursuse iga sektsiooni kujul. Sama nime uimastite arv komplekti peaks olema piisav kõigi klassiruumi üliõpilaste laboratoorse töö jaoks (15-20 tükki).
- Metoodilised soovitused tuleb lisada mikroklientide kogumile, kus tuleks anda uuritud mikro-objektide ja üliõpilaste sõltumatu töö ülesanded.
Õppeprotsessis olevate mikropreparaatide uuring jõuab teaduse meetodeid, mis võimaldab otsese tähelepanekute abil, et näha organismide struktuuri, nende osad.
Mikroskoobid on mikroskoopilised väikesed elusobjektid, nende elundite parimad osad ja osad. Need objektid on sõlmitud katte ja objekti klaaside vahel spetsiaalses lahenduses. Parema eristatavuse saamiseks on ravimid värvitud, nii et objektide värv on kunstlik.
1. Jah, töö alustamine mikrokraaniga on vaja kirjutada oma nime, laboratoorsete klasside teema.
2. Iga mikroskoopilise uuring algab mikroskoobi vaatamisega väikese suurenemisega (56x). Seejärel vali koht, kus osad on paremad nähtavad ja panevad suure kasv (120-300x) ja jätkake visandit. Mikroprotsessi joonistamisel on vaja järgida originaali üksikute osade suuruse suhet. Hankimine aitab meeles pidada ja luua objekti visuaalse idee.
3. Esiteks tähistab joonis põhielemente, seejärel täiendavad üksikasju. Joonisel on märgitud micropetsiatuuri nimi ja kasv, milles joonis on tehtud. Üliõpilaste sülearvuti ühel lehel tehke 2-3 jooniseid. Mikrospettuuri peamisi struktuure on näidatud kurjategijatega ja iga kirjutamise kohta, millele järgneb nende dekodeerimine. Mikroskoobi vaatevälja kontuuri ei tähendata.
Seega on olemas 2 microsPerraatsi tüüpi - ajutine ja konstantne. Nende erinevus on ladustamise ja toiduvalmistamise meetodite ajal. Mikro töötlemine peab vastama teatud nõuetele, mida tuleb hoolikalt jälgida. Mikrokiiri valmistamiseks on vaja spetsiaalseid seadmeid, mida kirjeldatakse järgmises lõigus.
§ 2. Mikro valmistamiseks vajalikud seadmed
Töölaual.
Erilise tabeli puudumisel saab mis tahes tabelit (eelistatult koos sahtlitega) kohandada eduga (eelistatavalt sahtlitega) tööpinnaga vähemalt 60 * 120 cm.
Kui tabeli kaas ei ole spetsiaalne kate, siis tuleb see olla valmistatud mis tahes niiskusekindlast materjalist. Tabeli tabelis, mis on ette nähtud otsese ettevalmistamise töö jaoks, on igal juhul vajalik klaasi katmiseks ja korraldage selle all väikese (9 x 12 cm) lehed. See loob sobiva tausta, mis hõlbustab töötamist värvitud (valge leht) ja värvimata (mustad lehed) objektid. Samuti on soovitatav mõlemale lehele kohaldada slaidiklaasi pinda, mis sisaldab katteklaasi asukoha ja suuruse määramist.
Selleks, et muuta see mugavamaks, et korraldada vajalikke seadmeid, peaksite olema reaktiivide, lahenduste ja roogade riiul, mis on paigaldatud kas enne töötamist (tabeli tagaosa) või asukohast sõltuvalt asukohast tabelist võrreldes valgusallikaga.
Klaasnõud.
Pulmad purgid sobivate pistikutega Erinevat võimsust 50 kuni 200 ml-d kasutatakse histoloogiliste patareide valmistamiseks, mis on ette nähtud erinevate kandjaga täita kudede tükki. Suuremad pangad kasutatakse kudede tükki kinnitamiseks ja salvestamiseks vedelike kinnitamiseks, objektide klaaside töötlemisel, neutraalse formaliini ettevalmistamisel jne.
Karude asemel võib kasutada liiklusummikuid, võib kasutada erinevaid kodupangad, millel on tina-kruvimisseadmed, erinevad mahud.
Fuces - väikesed ümmargused klaasist tassid erinevate läbimõõdude ja kõrgustega lihvidega kaanega.
Bioloogilised küpsised - ümmargune, ovaalne või nelinurkne (samuti kõrged fuces) kasutatakse slaidprillidele paigaldatud histoloogiliste osade juhtimiseks. Stabiilsuse andmiseks ja korralduse tagamiseks paigutatakse need puidust või plastist valmistatud spetsiaalsesse riiulitesse, sõltuvalt töötlemisviisist.
Petri tassid - lai, lamedad klaasist tassid kaanega - sobivad mitmesugustele manipulatsioonidele (maalimine vabalt ujuva ja liimitud slaidi slaididele, kasutage fuces'i all olevate toetustena jne).
Nõustused - erinevate võimsuste silindrid ja menniskid (10 kuni 250-500 ml) erinevate suuruste lehtkesi.
Keemilised tassid - ümmargused klaasist tassid ilma kateta mahuga 50-100 ml - kasutatakse laialdaselt histokeemiliste reaktsioonide läbiviimisel, klaasile liimitud värvi kärpeid jne.
Kolb (korter) - mahuga 50 ml kuni 2 liitrit. Väikesed kolbid kasutatakse erinevate värvainete lahenduste valmistamiseks ja ladustamiseks, mis on suured destilleeritud vees ja teistes suurtes kogustes veedetud vedelikes.
Pipetid Tavalist (ette nähtud ravimite süstimiseks) kasutatakse värvainete kogumiseks ja erinevate vedelike kogumiseks (mahuga 0,1-100 ml) kasutatakse erinevate vedelike väikeste koguste mõõtmiseks. Praegu kasutatavate automaatsete pipetide saab kasutada erinevate võimsusega.
Nahaklaas - ristkülikukujulised plaadid, mille suurus on 76 * 25 mm, paksus 1,2-1,4 mm, mis on ette nähtud osade paigutamiseks mikrokretäride valmistamise ajal. Paksemad prillid ei võimalda valgustite diafragma servade teravat pilti ravimi tasapinnas, kuna see selgub klaasi paksuses ja see häirib kondensaatori teravustamist ja vähendab järsult selgust pilt.
Jõuklaas - on õhukesed (0,15-0,17 mm paksus, paksemad prillid halvendavad erinevate suuruste pildi kvaliteeti) plaate. Serveeri katmiseks töödeldud sektsioonid, mis asuvad slaidiklaasidel. Kalaprillide suurus valitakse sõltuvalt objekti piirkonnast.
Vahendid.
Histoloogilises laboris kasutatavad tööriistad hõlmavad pintsetid, skalpellid, hemostaatilised klambrid, maisiklambrid, bakterioloogilised hinged spaatlid, vaktsineerimise nõelad on sirged ja kõverad, metallist ja klaasist. Klaasvardad on vajalikud hõbedase immutamise korral, kui metallist nõelad ei saa kasutada.
Samuti on vaja alkoholi, juuksed harja eemaldamiseks kärped mikrotomite nuga, filterpaber, nõelad, niidid, tihe paber märgistamise materjali, leukoplastika ja klaaspliiats.
Objekti prillide ettevalmistamine.
Histoloogiliste preparaatide saamiseks kasutatavad nahaprillid peavad valmistama valmistama. Erandiks on kasutusvalmis ja spetsiaalselt pakitud imporditud klaasist slaidid.
Naha klaasid pestakse sooja seebiveega või keedetakse 15 minutit 2-3% naatriumvesinikkarbonaadi lahuses, seejärel loputati kuuma veega ja pestakse mitu tundi jooksva veega. Prillide pesemine pühkige puhta puuvillase lapiga ja paigutatakse 96% alkoholile mitu päeva. Registreeritud prillid eemaldatakse pintsettide poolt selle seguga, pühkige puhta lapiga ja keerake kasti.
Nahaprillid on samuti tugeva vesinikkloriidhappe lahuse hästi rasvatustatud. Mõne päeva pärast pestakse neid voolava veega ja kuivatatakse.
Kvaliteeti rasvaärastus saab kontrollida purjus slaidi vee pipett: vesi levib vee õhuke kiht ja ei lähe tilk.
Klaaside lõikamiste paremaks fikseerimiseks on see eelnevalt määritud valgu seguga glütseriiniga. Värske munavalge vahustatud ja filtreeritakse destilleeritud veega niisutatud suure poorse filtri kaudu, seejärel segati võrdse mahuga glütserool ja lisatakse mitmed tümooli kristallid. Segu säilitatakse mitu kuud. Segu kasutatakse ka, mis koosneb 15 ml vereseerumist, 5 ml destilleeritud veest ja 6 ml 5% formaliini. Pärast filtreerimist on segu valmis libisemiseks. Selle kasutamine annab parima tulemuse kui munavalgu kasutamine, kuna taust ei ole maalimisel moodustunud.
Ühe käega keerduva slaidi klaasi valgustamiseks võetakse 5-6 klaasi ventilaatori kujul ja teisele - puhta klaasvõlli, mida rakendatakse valguga, puudutades iga klaasi. Siis valk hõõrutakse rasvata alkoholiga sõrmega klaasi pinnale oma keskele, kaasas kerge pingutusega. Mõned autorid on soovitatav soojendada klaasi termostaat, kuid kogemus näitab, et see on tarbetu, sest pärast kärpete ülekandmise klaaside nad paigutatakse termostaadis või spetsiaalses tabelis kuivatamiseks, kus valgu koagulatsiooni on samal ajal.
Arendatakse meetodit lõigatud klaasile, ilma eelnevalt hõõrumata viimase valgu glütseriiniga.
Sooja destilleeritud veega vannis tilgutatakse mitu tilka vedelikuga kaseiini liimi ja segatakse. Viilud langetatakse saadud pöördvedelikuks vedelikuks, saame teha vaakumi nõel ja saagi puhta madala rasvasisaldusega klaasile.
See meetod annab järjekindlalt hea mõju ja puudub värvitud tausta ümber lõigatud, nagu sageli juhtub, kui kasutatud valku.
Seega spetsiaalsed seadmed ja vahendid on vaja valmistamiseks mikrokiirused. Peamised on sisulised ja katteklaasid. Enne mikrosaaduse valmistamise alustamist on vaja korralikult valmistada slaidiklaasi. Nende ladustamiseks esitatakse ka erinõuded. Kuid ühe seadme ettevalmistamine ei ole mikrokraani ettevalmistamiseks piisav, on vaja valmistada ka materjale uurimiseks. See on üksikasjalikult öeldud järgmises lõigus.
§ 3. Materjali ettevalmistamine mikrokooride valmistamiseks
Mikropreparaadid jagunevad ajutiseks ja konstantseks. Ajutiste preparaatide materjali valmistamine hõlmab kinnitamist ja maalimist.
Fikseerimine on rakuliste struktuuride kiire säilitamise protsess, milles kõik füsioloogilised biokeemilised protsessid peatuvad ja vees lahustuvad ained lähevad lahustumatud olekusse. Järelikult võimaldab fikseerimine säilitada rakusiseseid struktuure samaks pikka aega. Rakkude kinnitamisel võivad artefaktid ilmuda - uued konstruktsioonid, mis puuduvad elusrakkudes, näiteks erinevaid vakuoolid. Artefaktide välimuse vältimiseks on vaja kasutada spetsiaalselt valitud keemilisi lahendusi - klambrid ja fikseerimine ise tuleks läbi viia teatud tingimustel. Eelkõige on soovitav kasutada jahutatud lukud (kuni 2-3 kraadi); Füüsimiseks, peate võtma individuaalseid rakke või kangate tükki ei ole paksemad kui 5 mm; Hääletaja ulatus peab ületama fikseeritud materjali mahtu 50-100 korda; Salvestajat ei tohi kasutada materjali pikaajaliseks säilitamiseks; Salvestajat ei tohiks uuesti kasutada.
Kaaluge kõige levinumate klambrite koostist ja rakendamist.
Formaliin (formaldehüüd või ant aldehüüd). Lihtsaim ja kõige levinum kinnitus. Seda kasutatakse veepõhiste lahuste kujul, mille kontsentratsioon on 4-10%, samas kui 100% müügi formaliini kontsentratsioon. Müük Formalin sisaldab sipelghappe segu, mis neutraliseeritakse süsinikdioksiidi poolt 24 tundi. Fikseerimisaeg 1 tund kuni 24 tundi. Pikaajalise säilitamise puhul kantakse materjal üle värske 10% formaliini. Pure formaliini kasutatakse, kui planeeritakse ensüümide lokaliseerimise ja aktiivsuse edasist uurimist. Sagedamini on formaliin kaasatud keerukamate klambrite kujundamisse.
Alkoholi klambrid. Sisaldama etüül- või metüülalkoholi. Alkoholide vesilahused puhtal kujul (70%, 96% või 100%) on suhteliselt harva kasutatud. 100% alkoholi kasutatakse sagedamini, mis on segatud teiste ainetega. Tuleb meeles pidada, et metüülalkohol (metanool) ja selle paari on mürgised.
Universaalsete lukkudena kasutatakse erinevaid formaalsel, alkoholidel, orgaanilistel hapetel ja anorgaanilistel ainetel põhinevaid kompositsioone.
Äädikal alkohol (atsetaali tööstus). See on üks lihtsamaid lukke. See koosneb 3-st absoluutsest alkoholi (etüül ja parem metüül) ja jäise äädikhappe osa osast. 100% (absoluutse) alkoholi valmistamiseks on esialgsed alkoholid dehüdreeritud. Veevaba vasksulfaati kasutatakse etüülalkoholi (etanooli) dehüdraatimiseks ja metüülalkoholi dehüdratsiooni (metanooli) dehüdreerimiseks (metanool), kaltsiumoksiidi kasutatakse. Hoidke neid hermeetilistes nõuddes. Tuleb meeles pidada, et kõik absoluutsed alkoholid on eriti mürgised. Jää-äädikhappe valmistamiseks jahutatakse esialgne kontsentreeritud hape külmkapis; Samal ajal külmub happega, varem kui vesi. Vedelik tühjendatakse ja külmutatud hape sulab ja kasutatakse kinnitusvahendite valmistamiseks. Häälutus on kasutamiseks valmis kasutamiseks 24 tunni pärast. Hoidke kinnitusvahendit pimedas külmas kohas. Lukustusaeg - 2 ... 24 tundi. Seejärel kantakse materjal värskesse kinnitusrattale üle, kus seda saab külmkapis salvestada kuni 1 kuu. Pikema säilitamise puhul kantakse materjal üle 70% alkoholile.
Carnuise lukk. Koostis - absoluutne alkohol - 10 cm3 ; Kloroform - 3 cm3 ; Äädikhape - 1 cm3 . Lukusta fikseerimine 1-3 tundi.
Pilmuhappe sisaldavad fikseerijaid, näiteks meande segu - 15 ml küllastunud vesilahuse segu: 5 osa formaliini: 1 osa jää-äädikhappe osast. See kinnitusvahend valmistatakse vahetult enne kasutamist. Fikseerimisaeg 1 kuni 24 tundi (mõnikord paar päeva). Fikseeritud materjali säilitatakse 70% alkoholi.
Suleixi sisaldavad fiksaatorid (elavhõbekloriid (II) - HGCl2 ). Sulema kasutatakse küllastunud vesilahuse kujul musti äädikhappega (25: 1), formaliini (8,5: 1) ja keerulisemate kompositsioonide ("Susa" lukk, Cenkeri lukk jne). Lukustusaja 1 kuni 24 tundi. Seejärel eemaldatakse Suleix joodi alkohoolse lahusega (6 70% alkoholi osa: 1 osa joodi tinktuurist) ja joodi eemaldatakse 70% alkoholiga. Fikseeritud materjali säilitatakse 70% alkoholi.
Osmiumi sisaldavad fiksaatorid (nelja-terava osmiumi või osmiumhape). Saada parimad tulemused, mida kasutatakse ravimite valmistamisel nii kerge ja elektronmikroskoopia jaoks. Saate kasutada 1-2% fosfäärhappe lahust, kuid sagedamini kasutatakse kompositsioone näiteks flopivooduli - 15 osa 2% osmiishape: 1 osa jää-äädikhappe osast. Fikseerimine toimub aeglaselt (24 tundi kuni mitu päeva).
Lisaks loetletud üldistele aplikaatoritele on olemas ka spetsiaalsed klambrid. Näiteks mitokondriaalne kinnitus sisaldab 4 osa kaalium-dikromaadi 3% osast ja 1 osa 40% formaliinist. Kloroplastide lukk sisaldab 15 osa küllastunud vasksulfaadi lahusega, 1 osa 40% formaliini ja 5 osa veest.
Mõnel juhul kasutatakse keemilise fikseerimise asemel proove kiiret külmutamist, näiteks vedelas lämmastiku temperatuuril (-1960 ) või kuiva jäätemperatuuril (-780 ). Külmutatud esemeid saab veetustada vee sublimatsiooni vaakumis temperatuuril alla -400 (Seda protsessi nimetatakse lüofiliseerimiseks).
Värvimine võimaldab teil tuvastada intratsellulaarseid struktuure suurenenud afiinsusega teatud värvainete suhtes. Värvid on suhteliselt madalad molekulmassiga orgaanilised ained, suurenenud afiinsusega teatud raku keemiliste komponentide suhtes.
Seal on palju värvaineid, mida kasutatakse erinevatel eesmärkidel. Tuleb meeles pidada, et värvide valik on seotud rakkude fikseerimise ja mitmesuguste meetoditega rakkude eeltöötluse meetoditega.
Värvainete nimed võivad vastata tulemusele (rubiin, karmiin, metüleenininine, metüleensinine, metüleen-sinine, metüülaroheline, oranž kuld). Mõnikord asendatakse värvide vene nimed saksa keeles, näiteks: metüülblau, air. Muudel juhtudel on nimed ajalooliselt välja töötatud, näiteks: Püroniin, fuksin, safraniin, floreoglutsine, Sudaan III. Mõnikord ei sobi värvaine nimi saadud värvile, näiteks sinine tioniin annab lilla-punase värvimise. Keemilised nomenklatuuri nimed värvid on üsna harva, näiteks: dimetüülaminobensaldehüüdi, 8-amino-1-nafal-5-sulfoonhape.
Seal on aluselised (leeliselised), happelised ja neutraalsed värvained. Peamised värvid värvivad selektiivselt basofiilseid rakulisi struktuure (st happeliste omadustega struktuurid). Happevärvid selektiivselt värvivad acidofiilsed või oksüfly rakulised konstruktsioonid (st aluselise omadustega struktuurid). Neutraalseid värvaineid värvitakse ja basofiilsed ja acidofiilsed struktuurid.
Rakkude elu jooksul kasutatakse kõige vähem mürgiseid värvaineid. Neid värvaineid kasutatakse tavaliselt vesilahuste kujul, näiteks metüleensinist (kontsentratsioon 1: 1000 kuni 1: 10000), tripani sinine (0,5% lahus), neutraalne punane (1: 50000 kuni 1: 200000).
Fikseeritud rakkude värvaineid võib kasutada puhtal kujul (vesi- või alkohoolsed lahused, kontsentratsioon 0,1% -lt 1% -ni), näiteks: eosiin, fuksin. Värvainete segud kasutatakse sageli näiteks Romanovsky-Gimme segu (sisaldab metüleen-atsüroo, metüleenist lilla, metüleenist sinist ja eosiini), värvimist mulldari (acid fuchsiini S järjestikune kasutamine ja seejärel aniliini sinine segud Orange Gold G), Azur eosiin, metüülblau-eosiin.
Siiski sagedamini moodustub värv selle ettevalmistamise ajal. Näiteks tuntud taimse päritolu hematoksüliini tuntud aine muutub värvuseks alles pärast selle oksüdeerimist Hematootleini. Nuklei ja kromosoomide värvimiseks kasutatakse värvaineid laialdaselt orgaaniliste hapetega. Mõtle meetodite küpsetamiseks mõned kõige lihtsamad värvained.
Küpsetamine 2% atsetofuxiini. 1 gramm peamisest fuchsiinist lahustatakse veevannis kuumutamisel 50 ml äädikhappes.
1% atsetorvorseini valmistamine. 1 Ralmile lisatakse 50 ml jää-äädikhapet ja nõudma umbes 12 tundi. Seejärel kuumutatakse segu keema ja lisatakse 50 ml destilleeritud vett. Seejärel kuumutatakse keema ja jahutati, korrates seda protseduuri 10 korda. Pärast ühe päeva filtriti värvaine. 1 Osa 1 N lisatakse enne värvimist 9 värviosale. HCI.
4% atsetokarminali valmistamine. Lahus valmistatakse soojusresidendi kolvis vee külmkapis. 4 grammi atsetokarja segatakse 100 ml 50% äädikhappega ja keedetakse 1 tund. Pärast ühe päeva filtriti värvaine. Samamoodi valmistatakse atsetolakmoid valmis.
Äädikhappe asemel kasutatakse sageli teisi orgaanilisi happeid, näiteks 40% piimahape.
Kõik värvained pärast keetmist filtreeritakse ja salvestatakse pimedas jahedas kohas. Värviliste ravimite aeg sõltub temperatuurist (tavaliselt 20 minuti kuni 1 päevani). Kuumutamisel või keetmisel väheneb värvimisaeg.
Lisaks orgaaniliste värvainete värvimisele võib individuaalseid struktuure eraldada nende immutamise abil hõbedaste ja teiste metallidega.
Seega on vaja mõningate ajutiste mikrokriteeriumide valmistamisel vajaliku materjali fikseerimist ja maalimist. Tänu sellele on parem kaaluda objekti mikroskoobi all. Täpsemalt me \u200b\u200bräägime mikroraparaatide ettevalmistamise meetoditest neljandas lõigus.
§ 4. Mikrohoolduse valmistamise meetodid
Ajutiste mikroettevõtete valmistamisel on vaja järgida järgmist toimingute järjestust:
1. Peske ja pühkige hoolikalt sisulist ja katteklaasi. Et mitte murda väga habras katteklaasi, on vaja panna see klappidesse salvrätikud vahel suurte ja indeks sõrmede parempoolse ja hoolikalt pühkige see ringikujuliste liikumisega sõrmede.
2. Kandke vedela tilk (vesi, glütserool, lahuse, reagendi või värvaine tilk.
3. Tehke uuritava organi lõikamine tera abil. Tera peaks olema väga terav.
4. Valige kõige õhem lõigatud, edastage see vaakum nõel või õhuke harja keskele vedeliku slaidi klaasi keskele.
5. Sulgege põhja katteklaasiga, nii et õhk ei tabanud seda. Selleks katta klaas kahe sõrmega mahajäetud ja tuua alla alumise joone serva vedeliku tilk ja sujuvalt alandada seda.
6. Kui on palju vedelikke ja see tuleneb katteklaasi all, eemaldage see filtripaberi abil. Kui õhuga täidetud kohad jäid katteklaasi alla, lisage seejärel vedeliku, asetades selle katteklaasi serva kõrval ja vastasküljelt filtripaberist.
Bioloogia ja ringkondade juhtide õpetajate ees on liiga vara või hilinenud ülesandeks teha koolitus mikrokoolitus. Milline aine suudab bioloogilise objekti pikka aega kinnitada ja kuidas seda protseduuri lihtsustada ja taskukohase teha. Kuulsad balsamid (vaiguga lukustamine) ei ole kunagi töödeldud kergesti ligipääsetavate ainetega, eriti suurte linnade kaugusel. Lisaks ütlevad nad, et need ained ei ole kahjutu. Ja lõpuks on nende kasutamise protsess üsna raske.
Ravimi valmistamiseks saate kasutada PVA liimi. Oluline on, et ravim oleks niiske, hästi niisutatud ja liim on värske ja kergelt lahjendatud puhta külma keedetud veega soovitud kontsentratsiooniga (liim kujutab emulsiooni ja on kergesti lahutatud). Pärast mitmeid proove ja vigu, soovitud kontsentratsioon tehakse ja määrata ilma raskusteta.
Siis tilk vett - keedetud või destilleeritud puhtale klaasile. Vesi tuleb täpselt eemaldada puhta, ei jäta karvad lapiga või filtripaberiga, nii et klaas oleks kergelt niiske. See, samuti proovi niiskus aitab kaasa ühtlase (ilma mullideta) niisutamisel. Valmispinnal on vaja rakendada väikese languse enne PVA valmis liimi, nii et õhumullid ei ilmu. Mõnikord ei häiri nad, vaid ravimi rikkumise välimus. Selles langus on eelnevalt valmistatud viilu või proov läbi viidud, näiteks eelnevalt pakkinud sooja vee Daphy. Seejärel sujuva kaldega liikumisega on vaja katteklaasi panna ka puhtaks ja kergelt niiskeks. Plaase vaheline liimi kiht peaks olema võimalikult õhuke.
Kui midagi ebaõnnestus, on proov väärtuslik ja üsna suur, peaaegu alati, erinevalt vaigust, on võimalik seda hõlpsasti pesta ja protseduuri korrata. Ülejääk liimi korralikult pestakse õhuke voolava veega; On vaja järgida, et see ei registreeru prillide vahel. Katteklaas peab toimuma. Veidi hägusate vee jääkvoolu saab hoolikalt eemaldada filtripaberit või õhukese kanga riba ilma vaiata.
Valmis ravimid tuleb laguneda sooja kuivas kohas. Valmistise valmistamise näitaja on selle läbipaistvus. Sõltuvalt väga paljudest teguritest jätkub läbipaistva seisundi kuivatamine ühe kuni nelja nädala jooksul. See juhtub, et liiga paks kiht liimi või liimide saastunud lisandite on täiesti läbipaistev, see ei süvenda pilti mõnevõrra, kuid tänu väikese sügavuse teravus mikroskoobi, isegi sellised ravimid on saadaval uuring.
Ei ole mingit garantiid, et seda meetodit saab kasutada mis tahes ravimite valmistamiseks, kuna mõned neist nõuavad värvimist ja värvained võivad liimiga suhelda.
Nn Syzranist 23 Bioloogia ja ökoloogia õpetaja ja ökoloogia Õpetaja ja ökoloogia soovitab Syzranist järgmist mikrokraani toiduvalmistamise meetodit. Võite võtta tavalist želatiini, valage see veega turse jaoks. Siis supilusikatäis helistada mõned paisuvad želatiin (ilma veeta) ja soojuse tulekahju. Kui želatiin dispersioon (see ei ole vajalik selle keemata), langetage see slaidile. Selles langus panna proovi ja sulgege katteklaas, vajutada seda hästi ühtlase jaotus želatiini. Mikropreparatsiooni valmis.
Kaetud klaasi asemel saate kasutada tsellofaani, kui katteklaasi ei ole. Lisaks on Cellofaanil üks eelis: mikroprotsessi ei saa purustada, sest Cellofan on elastne ja ei pragunemist nagu katteklaas.
Gelatiini puhul on vaja kiiresti töötada, vastasel juhul külmub see. Aga kui see juhtub, on piisav, et klaasi hoida tulekahju - ja želatiin muutub taas vedelikuks. Gelatiin on kahjutu, kättesaadav ja väga ökonoomne.
Taimede osade valmistamine
Sektsioonide valmistamiseks võtab objekt vasaku käe suurte ja indeksi sõrmede ja skalpelli või nuga abil joondage selle pind. Paremal käes võtke tera või raseerija ja tehke need objektile ja paremale objektile sujuva kiire liikumise (vt joonis 1, a). Sektsioonid peaksid olema väikesed ja õhukesed. Need eemaldatakse teradest pehmest tassist ja kantakse slaidiklaasile keskmise tilk (vt lisa joonisel fig 1, b).
Väikeste objektide osade valmistamiseks paigutatakse viimane vanema südamikku (vt joonis 2), olles eelnevalt teinud selle lõigatud või süvendi ja operatsiooni tehakse eespool. Sektsioonide tootmiseks kasutatav tera peaks olema terav (see peaks juukseid kergesti lõikama).
Mikropreparatsiooni Botanica
Epiderma Cutoff'i ettevalmistamine Virgin Tradessska lehe allosas vees.
Ravimi valmistamiseks on tradeesüüsi leht vasaku käe indeksi sõrme ümber nii, et lilla värvi alumine külg pööratakse väljapoole. Parema käe abil vaba nõela abil leevendada epidermi keskel vestiga lehe keskel ja pintsetid eemaldada selle tükk. Samal ajal osa lehel paberimassi (mesofülli) on tahtmatult pildistatud, kuid tavaliselt leida õhukese sektsiooni perifeeria, mis koosneb ühest epidermaalsete rakkude rida. Torn viilu panna slaidi tilk vett väljas kõrvalt üles ja katteklaasiga katte.
ELDINE rakkude rakkude Kanada rakud.
Eldine'i ülemises osas põgeneda pintsettide abil, rebige leht ja liigutage vett klaaslaiust. Leht tuleb asetada objekti klaasi alumisele küljele.
Kromoplaste valmistamine küpsete puuviljade rakkudes.
Mis abiga ettevaatlik nõelaga, võtke väikesed tükid küpsema oru puuviljade tselluloosi, Rowan ja Rosehip. Asetage iga veepakk vee tilk vett slaidi ja õrnalt jagada rakud. Kate katteklaasiga.
Kartulite tärklise terade valmistamine.
Lõika kartulitugevus. Värske lõigatud pinnaga võtke skalpellile väike kogus vedelikku ja edastage vee tilk vett slaidiklaasile, katke katteklaas.
Pirnide rakkude roclodeside valmistamine.
Värske või fikseeritud pirnide alkoholiga viilu peal, leidke nende eemaldamine kivirühm, eemaldage need. Asetage slaidile ja andke skalpelli ots.
Rakenda 1% florerhlutsiini languse tilk 50% etanoolis, seejärel lisage mõne tilka kontsentreeritud vesinikkloriidhappe (kontsentreeritud happega töötavatel ohutusnõuetel tuleb järgida).
Soe kestad omandavad kirsipunase või karmiiniku värvi.
Pärast värvimise ilmumist eemaldage reaktiiv filtripaberiga, lisage glütserooli tilk ja katta ettevalmistus katteklaasiga.
Taime maorakkude valmistamine.
Leheosa alumise epidermi mitmed osad valmistatakse ja panevad need 2 tundi 5% glütseriini lahuses. Sektsioonid asetatakse slaidile samas lahuses. Kaaluge ravimit.
Seejärel vahetage glütseriin vees, tõmmates selle klaasi all filtripaberi all. Vaadates seda, mis on muutunud.
Pärast seda asendatakse vesi 20% glütseroolilahusega või sahharoosi 1M lahusega. Vaata muutusi (vt lisa Joonis 3).
Mikrokrugide valmistamine zooloogial
Ravimi valmistamine hõivatud infusiooni lihtsamate organismide valmistamine.
Klaaspulga abil asetage metüültselluloosilahust slaidiklaasile.
Pipett tilk sellesse lahusesse heinainfusiooniga. Katta katteklaasiga tilk. Mõtle mikroskoobi[ 6 ] .
Mikroaterite valmistamine inimese füsioloogias
Narkootikumide määr verd leukotsüütide valemi uurimiseks.Kuivaklaasi klaasile kantakse vere tilk (vt lisa joonis 4, a). Peatklaas paigaldatakse subjektile 45 ° nurga all. Vere, kui võtate ühendust lihvklaasi levib mööda selle serva (vt lisa Joonis 4, B). Pärast seda edendatakse lihvklaasi kiirele liikumisele, libistades slaidiklaasi pinnale. Sellisel juhul purustatakse veres õhukese klaasi õhukese ühtlase kihiga (vt lisa joonisel fig 4, b).
Hästi keedetud vere määrdumine näeb välja nagu kliirens kollakas, ühtne ja läbipaistev. Sel juhul asuvad ühtsed elemendid selles ühes kihis.
Mikrobioloogide valmistamine
Mikroorganismide surnud rakkude ravimite valmistamine.
Mikroorganismide üksikasjaliku uuringu jaoks kasutatakse fikseeritud mikrokoorid. Mikroobide kinnitamisel tapetakse ja värviti.
Fikseeritud preparaatide valmistamine koosneb järgmistest toimingutest: määrdumise ettevalmistamine, ravimi kuivatamine, selle fikseerimine, värvimine ja kuivatamine.
1 etapp: masowing tehnoloogia (vt taotlus FIG. Viis).
- Valmistamine määrdeaine tihendi toitainete söötmega
- kooritud kalle klaasile rakendatakse väikese füsioloogilise lahuse tilk;
- paremas käes võtta bakterioloogiline silmus vasakul - katsetoru kultuuriga;
- silmus steriliseerides, tuues selle põleti leegile vertikaalases asendis (vorsti hõõguv) (vt joonis 5-1);
- eemaldage toru katseklaasist, haarates teda parema käe väikese sõrmega ja põletas testitoru serva alkoholile (vt lisa Joonis 5-2,3);
- loop viiakse toru, jahutatakse selle, puudutades seinad, mille järel väikese koguse kultuuri eemaldatakse söötme pinnalt (vt joonis 5-4);
- silmus eemaldatakse ilma toru seinte puudutamata, põletage katseklaasi servad alkoholi peale ja sulgege pistik (vt joonis 5-5,6);
- püütud mikroobivastane kultuur on valmistatud füsioloogilises lahuses, hoolikalt segatud ja ühtlaselt jaotatud klaasi kaudu ovaalse, ringi või ruudu kujul, mille pindala on 1-1,5 cm2 (Vt lisaliigend 5-7);
- lõpus valmistamise määrde, silmus uuesti steriliseerida (vt lisa joonisel 5-8).
- Vedelate toitainekandjate kultuuride valmistamisel rakendatakse 1-3 silmuseid uuringu all olevat materjali rakendatakse ja jaotatakse ühtlaselt; Sellisel juhul ei ole soolalahuse kasutamine vajalik. Järgmine saabumine, nagu eespool kirjeldatud.
2. etapp: määrdete kuivatamine.
Keedetud insult kuivatatakse õhus, põleti leegi (kuid mitte leegi) leegile sooja õhu voomis või termostaadis.
On vaja teada, et küte võib häirida mikroobide struktuuri, samuti asjaolu, et mitte kuivatatud ettevalmistuse lõpuni fikseerimise ajal ei riku.
3 etapp: määrde kinnitamine.
On füüsilisi ja keemilisi meetodeid. Klaasi füüsilise meetodi kinnitamisel ülespoole suunatud insultiga, kulutada aeglaselt leegi läbi 3-4 korda. Samal ajal surevad mikroorganismid, värvus kinnitatakse klaasile ja seda ei pesta ära. Mikroobide alarihmunud mumbalt pestakse ära, mikroorganismide hävitamine täheldatakse korduvates mikroorganismide hävitamist, st eraldi fragmentide dekompressiooni.
Keemilise meetodiga fikseerimine saavutatakse määrdete kokkuvõtmisel kinnitusvedelikuks, mis võib olla:
Alkohol (15-20 min)
Alkoholi eetri (10-15 min)
Metüülalkohol (5 min)
Kloroform (paar sekundit)
Jahutatud atsetoon (5 min)
4 etapp: värvimine määrdunud.
Värvides mikroorganismid on suur diagnostiline väärtus. See on keeruline füüsikalis-keemiline protsess, mille mehhanism on adsorptsiooni, kapillaarsuse, kemikaalide afiinsuse nähtused värvainete ja värvitud objekti pH-d, mis asuvad nende asukoha pH-st.
On lihtne (ligikaudne) ja kompleksseid (diferentsiaal) mikroorganismide värvimismeetodeid.
Lihtne värvimine.
Bakterite lihtne värvimine näitab ainult nende morfoloogiat (mikroobide kuju, suurus ja vastastikune paigutus). Tavaliselt kasutatakse ainult ühte värvi (metüleenist sinist või gooliotsat). Segage positiivseid ja negatiivseid värvaine meetodeid.
Positiivne:
- Keedetud ja fikseeritud määrdumise asetatakse vanni üle spetsiaalse silla.
- Rakendage mõnda värvainet teatud aja jooksul (värvi kogus peaks olema nii, et katta kogu määrdepind, paar tilka). Samal ajal on vaja tagada, et värvaine ei suuda määrduda, kui see on vajalik, valatakse värvi uued osad.
- Siis pestakse hoolikalt ja kiiresti pesti veega.
- Kuivatatakse filtripaberiga.
- Kandke keelekümblusõli ja mikroskoopilise tilk.
Ebaõige peetakse kvaliteetseks, kui bakterid on paigutatud üksteisest eraldatud ja ühtlaselt värvitud.
Negatiivne:
Sellisel juhul maalitud meetodit mudeli taustaga ja mikroorganismid jäävad värvimata. Seda kasutatakse mikroorganismide uurimiseks, mille kestad on halvasti tajutud aniliinvärvide poolt (Leptospira, spiroketid).
- Teemaklaasi servale rakendatakse rümpade tilka ja segage oma silmus kultuuri tilga.
- Lõike on valmistatud maapinna serva ääres sarnaselt vere määrdumite valmistamisele (vt joonis 6). Teemaklaas pannakse horisontaalsele pinnale ja jääda vasakule käele; Parempoolne tilk liigutatakse nurga all 450 Lihvklaas, mille serva, mille langus on ühtlaselt levinud; Vahetult, tihedalt vajutades lihvklaasi samasse asendisse nurga all, edendas seda objekti klaasi vasakule, saades ühtlase määrdumise.
- Nad annavad kuiv ja mikroskoopia.
Diferentsiaal (keeruline) värvimine.
Kompleksne või diferentseeritud bakterite diferentsiaalsed meetodid põhinevad mikroobse raku füüsikalis-keemilise struktuuri iseärasustel. Luba, rakendades mitmeid värvaineid ja reagente, määravad raku morfoloogilised omadused ja konstruktsioonikomponendid (vaidlused, kapslid, lipurid jne).
Üks tähtsamaid meetodeid on maalida mikroobide grammi poolt. See on universaalne diferentsiaaldiagnostiline värvimismeetod ettepanek Taani teadlane 1884. Seda kasutatakse üheks mikroobide tegurite üheks võtmeks.
Värvimine mikroobide grammi.
Mikroobide haaravus sõltub bakteriaalse raku keemilisest koostisest ja rakuseina struktuuri keemilisest koostisest.
- Väike tükk filterpaber pannakse fikseeritud insulile ja genesioviolaadi lahus valatakse 1-2 minutit.
- Eemaldage paber, tühjendage värv ja ilma veega pesemata, valati lugollahuse 1 minutiks (määrdunud täitematerjal).
- Raamistik alkoholiga 30 sekundit (sukeldatud tassi 2-3 korda).
- Pesta veega.
- Lisaks lahjendati lahjendatud fuksiniga 1-2 minutit.
- Värvige värvi, pestakse veega, kuivatage filtripaberiga kuivamist, uuritakse sukeldussüsteemiga.
Grami-positiivsed mikroorganismid on värvitud lillaga, ei ole alkoholiga värvitud ja ei tajuta peamist fuchsiini. Gram-negatiivsed mikroorganismid on värvitud alkoholiga ja omandavad roosa-punase värvi fuchic värvimisest.
Kapslite tuvastamine negatiivse kontrasti järgi.
Väike arv rakke tahke toitainete söötmega pannakse silmusele lahjendatud fuksiini slaidi silmusele, mis on segatud rümpade tilgaga kaetud katteklaasiga ja vaadatakse mikroskoobi all. Ravimi halli taustal, värvitu kapslid, värvitud mikroorganismide ümbritsevad rakud värvitud roosa värvi.
Värvimine endosfore.
- Metüleensinine valatakse fikseeritud määrdumisse (Leferara).
- Värvus reguleeritakse keema, hoides klaasist klaasi üle leegipõleti. Nagu värvaine aurustub, lisatakse see. Värvi kolmekordne kestus, 10-15 sekundit.
- Slaid jahutatakse ja pestakse põhjalikult veega.
- Lisaks 30 sekundi jooksul on Soffraniini (või Fucane Cating) 0,5% vesilahus stiilis.
- Värv on tühjendatud, ravimit pestakse veega, kuivatatakse ja vaadake mikroskoobi all.
Õige värvimisega on vegetatiivsed rakud punased ja vastuolud on sinine (kerge roosa).
5 etapp: kuivatamine.
Klaasile jäänud vesi pärast pesemist eemaldatakse hoolikalt filtripaberiga või imemiseks paberi serva või kergelt vajutades paberitükki. Värvitud määrdeaine peab olema täiesti kuiv, kuna veejääkide vormid koos seederõliga, mida rakendatakse mudeli, turbiidi emulsioonile, mis häirib mikroskooperatsiooni.
Mikroorganismide elusrakkude ravimite valmistamine.
Mikrobide uurimise meetod elava vihasriigis on järgmised eelised:
- Mikroobid uuritakse puutumata kujul.
- Mikroobide jälgimine elusvormis võimaldab teil tuvastada mitmeid omadusi, mida tapetud mikroobidest ei tuvastata (aktiivse liikuvuse).
Samal ajal on meetodil mitmeid puudusi:
- Nende väikeste ulatuste tõttu värvimata mikroobide uurimise raskus.
- Võimetus keskenduda mikroobi pikka aega, sest see kiiresti liigub vaatevälja.
Mikroobide elusseisundis uuritakse neid "purustatud tilk", "rippuvad tilk" ja "jäljend", kaalub ka "agarifilm"; Mõnel juhul kasutab seda eluiga (elutähtsa) mikroobide värv.
Ravim "purustatud tilk".
Klaasklaasile rakendatakse tilk vett, mis on väikese uuritud mikroorganismide rakkude arv, segatakse ja kaetud katteklaasiga. Kasvatatud mikroorganismid ja korter ja vedela toitainete söötmes viiakse ära vee bakterioloogilise silmuse tilk; Vedel söötmes kasvatatakse steriilse pipettina. Mis pidev uuring mikroskorkable objekti serva kaaneklaasi, on soovitatav valada küünelakk, mis takistab ravimi kiire kuivatamist (vt lisa joonis 7).
Ravim "rippuvad tilk".
Kate klaasile rakendatakse silmuse või tavalise pliiatsi mikroorganismide suspensiooni tilk, mis keerake rippmenüüst ja asetatakse spetsiaalsele slaidile süvendamisega (hästi) keskel. Tilk peaks vabalt riputama, ilma servade ja kaevu põhja puudutamata. Süvendite servad on vaseliiniga eelnevalt määritud. Tilk osutub pitseeritud märgkambris, mis võimaldab objekti mitmepäevase jälgimise. Pikaajaliste vaatluste puhul valmistatakse steriilsetele klaaside kasutamisele ja mikroorganismide suspensioonile vedela toitainete söötmes. Bakteritega töötamisel kasutatakse seda harva (vt joonis 8 lisa).
Preparaadi ettevalmistamine.
Kuid agari keskmise, mille mikroorganismid kasvavad tahke muru või kujul üksikute kolooniate, lõigata väike kuubik skalpelliga ja edastada selle slaidile nii, et pind mikroorganismide seisab. Seejärel rakendatakse puhta katteklaasi murule või kolooniale, veidi pressitud silmus või pintsetid ja võtke see välja, püüdes mitte liikuda. Saadud ravim asetatakse tilk alla vee tilk vett või metüleensinine (1:40) slaidil. Imprint saab saada ka subjektiklaasis, kui me puudutame klaasiklaasi koloonia või muru pinda. Kasutatakse peamiselt streptomükettide lahutamise uuringus.
Ettevalmistus "agarovi film" (või "mikrokultuur").
Õhukeste steriliseeritud ja kuumutatud klaaslaiust rakendatakse steriilse kuuma pipetiga 0,2-0,3 ml kuuma agareiseeritud toitainete söötmega ja jaotatakse kogu klaasi pinnale. Pärast söötme kiiimist eemaldatakse silmus liigse agari liigse, jättes kaks õhukese osa filmi, katteklaasi suurusest. Bakteri aheluse või pipeti ruutude keskele kantakse mikroorganismi rakkude rakkude tilk. Klaas asetatakse niiskesse kambrisse (tass petri, millel on märgfiltripaberi kihiga), mis pannakse termostaati. Mikrokoopiate ees film kasvas mikrojõuga, värvaine tilk või tilk vett kile kuivatamise korral ja seejärel hoolikalt kaetud katteklaasiga.
Mikroobide värvimise tõstmine.
Mikroobide parema nähtavusega töötamise ajal võib vedelik olla veidi konserveeritud, sisestades katteklaasi all väikese värviga värvainet. Samal ajal värvitakse baktereid ja on mikroskoobi vaatevälja nähtav selgemaks.
1 värvimismeetod:
- Puhas klaasile rakendatakse metüleensinise küllastunud vesilahust.
- Anna kuivale.
- Klaas pühkitakse klaasiga, kuni põletamine ei aktsepteeri valguse sinise tooni.
- Uuringu all oleva materjali tilk kantakse klaasiga slaidi ja katete suhtes.
- Mikroobid maalitakse järk-järgult sinise värvi, jäädes elus.
2 Way maali:
Uuringu all oleva materjali tilk segatakse klaasiklaasil värviga (0,1-0,01%), kate katteklaasiga ja neid peetakse mikroskoobi all.
Seega uurisime, milliseid meetodeid nii ajutiste kui ka pidevate mikrokooride valmistamiseks, millest organisme neid saab valmistada. Leiti, et microsmurats kasutatakse laialdaselt kõigis bioloogilistes teadustes.
Järeldus
Teadusliku ja metoodilise kirjanduse uuring võimaldas meil teha järeldusi, mida microsmurats kasutatakse bioloogilise õppetundide laialdaselt ja selle jaoks peate neid tootma.
Mikropreparaadid jagunevad ajutiseks ja konstantseks. Ajutisi valmistisi ei salvestata, need on valmis laboratoorse töö ajal vahetult enne objekti õppimist. Püsivaid ravimeid saab salvestada juba aastaid. Neid toodetakse peamiselt tööstuslikest, kuid saate neid ise valmistada.
Mikro töötlemine esitatakse teatavate nõuete valmistamiseks, ladustamiseks ja kasutamiseks, mida tuleb järgida.
Enne klassi, õpetaja peaks juhendama õpilasi, kuidas korralikult käsitseda mikrokracy.
Erivarustus ja tööriistad on vaja valmistamiseks mikrokraapade bioloogia: naha klaasid, katteklaasid, pipetid, Petri tassid, erinevate kolvid, vaktsineerimisvardad, pintsetid, skalpels, alkohol jne seadmeid kasutatavatele seadmetele mikrokretärid, nagu Noh, ise mikropraapaatidele esitatakse ladustamise ja ettevalmistamise nõuetele, mis tuleb samuti järgida.
Mõnikord tuleb mikrokraiduse materjali fikseerida ja värvida, mille jaoks kasutatakse spetsiaalseid värvaineid ja klambrid.
Mikropreparatsiooni saab valmistada mitmel viisil. See on sektsioonide, määrdeainete, väljatrükkide valmistamine ja organismide elurakkude mikroseadiste valmistamine (riputamine, purustatud tilk, trükkimine, agarit film) - kõik need on ajutised mikro. Nende materjalide materjal võib olla taimede, kangaste, mikroorganismide erinevad osad.
Bibliograafiline nimekiri
- Bavto G.a. Töökoda taimede anatoomia ja morfoloogia kohta [Text] / G.a. Bavto, L.M. Erey. - M.: Uus väljaanne, 2002. - 464С. : Il.
- Mikrobioloogia [Tekst]: Bioloogide / Sosti üliõpilaste laboratoorsete klasside metoodilised soovitused. N. V. SHARYPOVA.- Seadus., Dopoli. - Shadrinsk, 2009. - 47 s., IL.
- Töökoda taimede anatoomia ja morfoloogia kohta [Text]: uuringud. Uuringute käsiraamat Kõrgem. Uuringud. Ettevõtted / V.P. Viktorov, M.A. Gulelenkova, L.N. Dorokhina et al; Ed. L.n. Dorokhina. - M.: Academy, 2001. - 176 lk.
- Mikrobioloogia töökoda [Text]: uuringud. Uuringute käsiraamat Kõrgem. Uuringud. Ettevõtted / a.i. Netrusov, ma Egorova, L.M. Zakharchuk et al.; Ed. A.I. Neturova. - M.: Academy, 2005. - 608 lk.
- Seminar taime füsioloogia [Text]: Uuringud. Uuringute käsiraamat Kõrgem. PED. Uuringud. Institutsioonid / i.v. PLANNIKOVA, E.A. Zhurukhina, O.B. Mikhalevskaya jt.; Ed. Vb Ivanova. - M.: Academy, 2001. - 144 lk.
- Sukhanova L.V. Sülearvuti laboritöö (7-8 klassi) [Text] / L.v. Sukhanova // September 1: Ed. Maja 1. septembril. - 2004. - № 25-26. - P. 36-46.
- Barinov og [Elektrooniline ressurss]. - Access Mode:http://bio.1september.ru/articlef.php?id\u003d200104304.. - pealkiri ekraanilt.
- Wikipedia [elektrooniline ressurss]. - Access Mode:http://ru.wikipedia.org/wiki/mikropreparat - pealkiri ekraanilt.
- Metoodilised soovitused [elektrooniline ressurss]. - Access Mode:http://freecode.pspo.perm.ru/080/work\u003e Koosoleku soovitus. HTM. - pealkiri ekraanilt.
- http://labx.narod.ru/documents/micropreparaty.html. - pealkiri ekraanilt.
- Mikroskoopiline tehnika bioloogia [elektrooniline ressurss]. - Access Mode:http://labx.narod.ru/documents/microskoop_slides.html. - pealkiri ekraanilt.
- Mikroskoopiline tehnika bioloogia [elektrooniline ressurss]. - Access Mode:http://labx.narod.ru/documents/prigotovlenie_micropreparov.html - pealkiri ekraanilt.
- Bioloogiaõpetaja veebisait [elektrooniline ressurss]. - Access Mode:http://tana.ucoz.ru/load/436-1-0-354 - pealkiri ekraanilt.
- Venemaa nurgas. Kuzbassi laad [elektrooniline ressurss]. - Access Mode:http://prirodakem.narod.ru/biblioteka/my_st/doci/kl_ob.htm. - pealkiri ekraanilt.
- Firma "uus Lyceum" [elektrooniline ressurss]. - Access Mode:http://novylicey.narod.ru/microprep_3_5.htm - pealkiri ekraanist.
- Elektrooniline raamatukogu Gaga (Gorno-Altai riiklik ülikool) [elektrooniline ressurss]. - Access Mode:http://elib.gasu.ru/eposobia/papina/malprak1/r_1_2.html - pealkiri ekraanilt.
taotlus
Joonis fig. 1. Käsipositsioon lõigatud (A) valmistamiseks ja lõikude eemaldamine raseerijalt (B)
Joonis fig. 2. Järjehoidja objekti keskmesse vanem.

Joonis fig. 3. Mikrokiratsiooni ettevalmistamine.
Katteklaasiga objekti katmine.

Joonis fig. neli. Verepuhastussüsteem

Joonis fig. 5. ravimi valmistamine

Joonis fig. 6. Mure valmistamine.

Joonis fig. 7. "Tasutav tilk": ülemine vaade ja pool

Joonis fig. 8. "rippuvad tilk": ülemine vaade ja pool
Ajutiste mikrokartide valmistamiseks on vaja omada sisulisi ja katteklaasi, valmistamisvardade, raseerijaid, skalpelsi, klaaspuhtade vee, pintsettide, filtripaberi, mõne reaktiivide valmistamisel.
Sisulist ja katteklaasi pestakse veega ja pühkige kuivus pehme lapiga. Köögiviljaobjekti õhuke viil asetatakse slaidile ja katteklaasiga katta vee tilk. Kui vedelik ettevalmistamisel ulatub kaaneklaasi servadest kaugemale, eemaldatakse liia filtripaberi ribade abil. Kui vesi ei hõlma kogu katteklaasi all olevat ala, rakendatakse pipetti katvuse klaasi serva lähedal, mida ise kinnitatakse klaasi all.
Kui on vaja tutvustada mis tahes maali reagendi vett katteklaasi all, imemiseks filtripaberiga ja reaktiivi tilguti rakendatakse vastasküljest katteklaasi servale.
Järgmised ained võivad olla värvi reaktiivid:
1) joodi, lahustatakse kaaliumjodiidis (tärklise terade tärklise terade jaoks rakkudes);
2) kloor-tsink-jood (tselluloosirakumembraanide värvimiseks);
3) florogütsiini ja vesinikkloriidhape (ilmastikutingimuste värvimiseks);
4) fuksin (tsütoplasmavärv);
5) hematoksüliin (värvimiseks nuklei jaoks);
6) Glütseriin (ravimi valgustatuse jaoks).
Kamber - peamine struktuuri- ja funktsionaalne üksus keha taim. Üksikulaarsete taimede puhul toimib raku kogu organismina multikullistes organismides rakkude diferentseerumist. Seetõttu on sellistes organismides olevad rakkude vorm ja struktuur väga mitmekesine. Täiskasvanute elusate köögiviljade rakk koosneb protoplastiga ümbritsetud rakulise kestaga ja mis sisaldavad mitte-elamute lisandeid (vaba ained ja lõplikud metabolismitooted).
Protoplast- Raku elusate sisu - koosneb organoide või hüaloplasma ümbritsev organelle. Orella võib jagada kolme rühma: kahe sillutatud - südamikku, plastiidid, mitokondrid; Ühe grammi - endoplasmaatiline reticulum (endoplasmaatiline võrgustik - EPS), Golgi, vaakuli, lüsosoomide, plasma (endoplasmaatiline võrgustik); Lammastamata - ribosoomid, mikrotuubulid, mikroflamentid. Galoplasmad. See on pidev kolloidne rakkude faas, millel on teatud viskoossus. See ümbritseb kõiki organelle ja tagab nende suhtlemise. Hüaloplasm koos organellidega, miinustuuma ja plastiididega tsütoplasma.
Tuum- Kohustuslik osa eukarüootne raku. See on päriliku teabe säilitamise ja paljunemise koht. Kernel toimib ka metaboolse juhtimiskeskusena ja peaaegu kõik rakus esinevad protsessid. Väljaspool südamik on kaetud kahekordse membraaniga - tuumakattega, lendudes pooride poolt, mille servad välimine membraan siseneb. Kerneli sisemine sisu - kromatiini ja nuclei sisemine sisu ja ribosoomidesse kastetud.
Mitokondrid - esineb kõigis elavatel eukarüootsetes rakkudes. Nende sisemised membraanivormid kasvavad mitokondrite õõnsuses plaatide või torude kujul, mida nimetatakse Cristesiks. Krimaate vaheline ruum täidetakse homogeense maatriksiga. Matrix vastab ribosoomidele ja nende enda DNA-le. Mitochondria peamine ülesanne on tagada raku energiavajaduste hingamine.
Platsioone- organellid leidub ainult taimerakkudes. Neid esindavad kloroplastid (rohelised), kromoplastid (kollased, oranžid, punased oranžid) ja leukoplastid (värvitu). Kloroplastidel on kahe maailma kest. Sisemembraan läheb kloroplasti õõnsusele mõne kasvava väljakasvatusega. Kasvu vahel on stroma. Kasvab ja stromed moodustavad õõnsuses kloroplastikompleksi membraanipindade süsteemi, eraldades spetsiaalseid korter kotid, kutsus tylacoide või lamell. Tillacoide moodustavad korstnad - tuumad. Tüülakoidide membraanides on roheliste taimede peamine pigment kontsentreeritud - klorofülli ja lisaained - karotenoidid.
Endoplasmaatiline reticulum - kolmemõõtmeline puukuoolide ja toruliitide süsteem, millel on tasased kotid või mahutid. Töötlemata EPS on valgu sünteesi sait ja kaetud arvukate ribosoomidega. Sujuvad EPS on ribosoomidest ilma lipiidide moodustumise koht.
Vacuole - õõnsused protoplastsete eukarüootsete rakkudes. Vacuools on derivaadid EPS, piiratud membraan - tonoplast ja täis vesine sisu - rakulise mahl. Noorte taimede rakkudes on vakuoolid toruliitide ja mullide poolkiite (provakoli), kuna need suurendavad rakke suurenemist ja ühendada ühe suurema vaakumi. See hõivab 70-90% rakumahust ja protoplast asub õhukese pealkirjaga kihi kujul. Enamasti suureneb raku suuruse suurenemine
Tuleneb vacuole'i \u200b\u200bkasvu tõttu. Selle tulemusena tekib tourrõhk ja säilitatakse rakkude ja kudede elastsus.
Rakumahl See on mineraalsete soolade vesilahus ja mitmesugused orgaanilised ühendid: süsivesikud (mono-, di- ja polüsahhariidid), valkude, orgaaniliste hapete ja nende soolade (kõige levinum sidruni, õuna, merevaigu, oksaalhapete ja nende derivaatide), alkaloidide ( Lämmastiki sisaldavad ühendid Paljud neist on taimsed mürgid, mõned kasutavad isik - kofeiin, atropiin, Cinene, morfiin, kodeiin), tanines (fenoolderivaadid), glükosiidid (Sukharovi derivaadid). Viimaste hulgas kõige huvitavam flavonoidide rühm (need on kahe peamise värvi pigmendid: mahlad - kollased ja antotsüansid - punane-lilla). Kõige sagedamini flavonoidid sisalduvad lillede periandirakkudes, mida nad annavad erinevaid värvi. Huvitav on see, et Anthocyans suudab värvi muuta sõltuvalt raku mahla reaktsioonist: nõrga happega - punase ja neutraalse või peamise sinise-lillaga. Lillede avamisel võib täheldada Anhocyanovi värvi muutmist ANTHOCYANOV-i avamisel - mitte, medmese või puistata kareda. Nende taimede pungad on roosad valged ja hägused lilled on sinised või lillad. Lisaks antrocian kroonlehed võivad sisalduda teiste osade taim - lehed, varred, juured, andes neile iseloomuliku värvi.
Masin Golgi. koosneb eraldi doktomeeridest ja golgi mullidest. Dokiosomes on korterite korstnad, mitte kontaktis ketta-juuste mahutid, mis on piiratud membraanidega. Golgi mullid on esitatud servadest dontioomite plaatide või torude otste servadest ja on suunatud plasmamama või vaakurele. Golgi mullid transportida saadud polüsahhariide.
Laboratoorse töö number 1Teema: "Küpsetamine ja erinevate organismide rakkude mikrofreetide kirjeldus."
Töö eesmärk: Turvaline võime valmistada mikrosicali ja vaadata neid mikroskoobi all, leida funktsioone struktuuri rakkude struktuuri erinevate organismide, oma teema terminoloogia.
Varustus:skin skaalalampide, inimese suu epiteelirakkude, mesilandi kultuuri, klaasi veega, mikroskoobi, tee lusikaga, katte ja slaidi, sinine tint, joodi, mikro-lüpsise loomarakud, sülearvuti, käepide, lihtne pliiats, line,
Edusammud:
Töö 1.
1. Kaaluge joonise jada kettide koorimise järjestust.
2. Valmistage klaas klaas, põhjalikult hõõruge see marli.
3. Pipett rakendage slaidil 1-2 tilka vett.
4. Vakuse nõela abil eemaldage hoolikalt väike läbipaistev nahk vööri kaane sisepinnast vööri sisepinnast. Pane tükk koorimiseks vee tilk ja sirgendage nõela otsa.
5. Kata nahk kaetud klaasiga, nagu on näidatud joonisel.
6. Mõtle ettevalmistatud ravim väikese suurenemise tõttu. Märgi, millised osad raku näete.
7. Värvige ravim joodi lahusega. Selleks rakendage joodilahust slaidiklaasil. Filtripaber teisest küljest Tõmmake lisalahus välja.
8. Kaaluge maalitud ravimit. Millised muutused toimuvad?
9. Kaaluge ravimi suure kasvuga. Leia kloroplastid selle lehtrakkudes, tumedat riba, ümbritseva raku, kesta; Selle all on kuldne aine tsütoplasmas (see võib kogu raku hõivata või seinte lähedal). Tsütoplasmas südamik on selgelt nähtav. Leia vaakuroon rakumahlaga (see erineb tsütoplasmast värvi).
10. Joonista 2-3 rakku vööri köis. Kirjeldage kesta, tsütoplasma, südamikku, vacuoli rakumahlaga.
Taimse raku tsütoplasmas on palju väikesi tales - plastid. Suure suurendusega on nad selgelt nähtavad. Erinevate elundite rakkudes on plastiidide arv erinev.
Plastide taimedes võivad olla erinevad värvid: roheline, kollane või oranž ja värvitu. Nahakaalu rakkudes on näiteks plastid värvitu.
Töö 2.
1. Valmistage heina kinni bakterid.
2. Kaaluge mikroskoobi all olevaid ravimeid.

3. Kaaluge multifirmalise loomaorganismi rakkude valmis mikromõõtmist.
4. Suspensioon, mida vaadatakse pildi objekti kujutisega.
Töö 3.
Mõtle valmis mikropealsete loomarakkude valmis mikropealsed mikropunktid.
Match näinud pildiga objekti pildil.

3. Märkige rakkude rakud kujutatud joonisel fig. neli
Laboratoorse töö number 2
Teema: "Plasmolüüsi ja demphalmolüüsi nähtuse jälgimine"
Eesmärk:veenduge, et elustaimede rakkudes ja füsioloogiliste protsesside kiirust on olemas plasmolüüsi ja dempromolüüsi nähtus.
Varustus: Mikroskoobid, Teema ja katteklaasid, klaaspulgad, veeprillid, filterpaber, soola sool, sibul.
Edusamme
Eemaldage vööri kaalu alumine nahk (4 mm 2);
Valmistage mikro-protsess, kaaluma ja visandama 4-5 rakke;
Kaaneklaasi ühel küljel rakendage paar tilka laua soola lahust ja teiselt poolt tõmmake vesi filtripaberi ribaga;
Kaaluge mikro-protsessi mõne sekundi jooksul. Pöörake tähelepanu muutustega, mis tekkisid rakumembraanidega ja nende muutuste toimumise aeg. Joonistage muutunud objekt.
Kandke kaaneklaasi ääres paar tilka destilleeritud vett ja tõmmake see teisele küljele filtripaberiga välja, loputades plasmolüüsilahuse.
Mõne minuti jooksul kaaluge mikroskoobi mikroskoobi all. Pange tähele rakumembraanide positsiooni muutusi ja nende muutuste aeg.
Match näinud pildiga objekti joonisel 1.
Joonista uuritud objekt.
Tehke järeldus vastavalt töö eesmärgile, märkides plasmolüüsi ja dempromolüüsi kiirust. Selgitage nende kahe protsessi kiiruse erinevust.
1. Kuhu vesi liigub (rakkudes või nendest) koe soolalahusesse asetamisel?
2. Miks saate selgitada vee liikumise suunda?
3. Kuhu vesi liigutamisel kanga veesse? Mis see on selgitatud?
4. Mis te arvate, et see juhtuks rakkudes, kui nad jäid pikka aega tahkes lahusesse?
5. Kas ma saan kasutada soolalahuse, et hävitada umbrohi?
6. Andke terminatsioonide määratlus - plasmoliid, defosmoliz, osmoos, turgor.
7. Selgitage, miks õunad on moosi vähem mahlakas?

Joonis 1. Plasmolüüs ja demplosolüüs
Laboratoorse töö number 3
Teema: "Taimede ja loomarakkude struktuuri võrdlemine Seened, bakterid."
Eesmärk:Õpi erinevate organismide rakkude struktuuri omadusi, võrrelda nende seas; Oma teema terminoloogiat.
Varustus:mikroskoobid, Teema ja katteklaasid, klaasid veega, klaaspulgadega, elevandi taime lehed, pärm, mesilandi kultuur, mikro-lüpsmise loomade mikro-rakud.
Töö 1.
1. Valmistage ravimi Eldine Lehtrakkude ravimi. Selleks eraldage leht varrest, asetage see slaidile tilk vett ja katke katteklaas.
2. Kaaluge mikroskoobi ettevalmistust. Leia rakkudes kloroplastid.
3. Joonistage ELDine lehe raku struktuur. Tehke oma joonisele pealdised. 4.Reat Joonis 1. Võistelda vormi, raku suuruste taimede erinevad organid

Joonis fig. 1. Taimede erinevate organite rakkude värvus, kuju ja suurused
Töö 2.
1. Lõika teelusikas vähe limaskest põske sees. 2. Asetage limaskesta slaidile ja sinine tint lahjendatud vees. Kata preparaat katteklaasiga. 3. Mõtle ravim mikroskoobi all.
Töö 3.
Kaaluge mitmesuguse loomaorganismi rakkude valmis mikro-raku.
Võrdle neid rakke nende seas.
Võrdlustulemused Sisestage tabelis 1
Vasta küsimustele:
Mis on rakkude sarnasus ja erinevus?
Millised on erinevate organismide rakkude sarnasuste ja erinevuste põhjused?
Praktiline töö
Teema : "Lihtsaimate ületavate skeemide koostamine."
Eesmärk: Lugege kirjutada kindlaksmääratud genotüübidega organismide moodustatud kaalude liigid; Registreerige lühidalt geneetiliste ülesannete seisundit; Lahenda situatsioonilised probleemid geneetikas; Kasutage geneetilisi terminoloogia oskusi.
Varustus: Õpetus, sülearvuti, ülesannete täitmine, käepide.
Edusammud:
Harjutus 1
Kirjutage kõik massid moodustavad organismid, millel on järgmised genotüübid: AABB, AA, MMPP, PPKK, AABBCC, AABBCCPP, AABBCC.
Sametete kirjutamise teel on vaja meeles pidada, et keha on homosügootne üks (AA) või mitu (AABBCC) geenid, kõik geenid on samad geenide puhul samad, kuna need kannavad sama alleeli.
Juhul heterosügous, üks geen (aa) keha moodustab kahte tüüpi hemehti, mis kannavad oma erinevaid alleelid. Digiterozygous organism (Aavb) moodustab neli kaalu. Üldiselt moodustab keha rohkem tüüpi hames kui suuremal arvul geenide ta on heterosigoten. Kaalude liikide koguarv on 2-ni, mille kraadi N, kus n on geenide arv heterosügootses seisundis. Tootjate kirjutamise teel tuleb juhinduda mängude "puhtuse" seadusest, vastavalt igale gametrile ühe igast alleeli geenidest.
Ülesanne 2.
Õpi lühidalt salvestada geneetilise olukorra probleemi ja lahenduse seisundi.
Lühikese dokumendiga on geneetilise probleemi tingimused, domineeriv funktsioon on määratud (a) ja retsessiivne - väiketähti (a) kiri vastava funktsiooni nimetusega. Genotüüp keha, millel on domineeriv märk, ilma täiendavate juhiste oma homo- või heterosügeneri seisundis probleemi, tähistatakse AGRi poolt, kus küsimus kajastab vajadust luua genotüübi probleemi lahendamisel. Organismi genotüüp retsessiivsete märgiga on alati homosügoten recalses alleel - AA. Põrandale kleepuvad sümptomid tähistatakse X-seotud pärandi korral xª või ha
Näide lühikeste rekordiliste tingimuste ja lahenduste kohta
Ülesanne. Inimestel domineerib Karelo värvi silma roll sinise värvi valikul. Blue-Eyed Naine abiellub heterosügootse porgandi mees. Mis on silma silmavärv?
Kokkuvõtlikud tingimused Kokkuvõte Lahendus
A - Karya Eye Color Vanemad - P AA X AA
A - sinine silmavärv gameta - g a ja
Vanemad: AA X AA OFFSPRING - F AA AA
Järglased? Karya värvi sinine värv
Ülesanne 3.
Kirjutage lühidalt geneetilise situatsioonilise probleemi ja selle lahenduse seisundi.
Ülesanne: Raamatupidamine Myoopia domineerib normaalses nägemuses. Tavalise nägemisega laps on sündinud Myntic Vanematest. Mis on vanemate genotüüp? Millised teised lapsed võivad sellest abielust olla?
Praktiline töö
Teema : "Geneetiliste ülesannete lahendamine".
Eesmärk: Õpi lahendada geneetilisi ülesandeid; Selgitage väliste tegurite mõju omaduse ilmingule; Kasutage geneetilisi terminoloogia oskusi.
Varustus: juhendaja, sülearvuti, ülesannete täitmine, käepide.
Edusammud:
1. Tuletame meelde märkide pärandi põhiseadused.
2. kollektiivse analüüsi ülesanded monohübrid ja digibiidi ületamine.
3. Sõltumatu probleemide lahendus mono-librad ja digibriidide ületamine, kirjeldades üksikasjalikult lahenduse kulgu ja sõnastada täielik vastus.
4. Kollektiivse arutelu õpilaste ja õpetajate ülesannete lahendamise ülesannete lahendamisel.
5. Tehke väljund.
Mono-librate ületamise ülesanded
Ülesanne nr 1. Veiste puhul domineerib geen, mis põhjustab musta villa värvi, mis määrab punast värvi määravat genoomi. Millist järglasi saame oodata homosügootse musta pulli ja punase lehma ületamisest?
Me analüüsime selle ülesande lahendust. Esialgu tutvustame märget. Genetics geenid, tähestikuline sümbolid võeti vastu: domineerivad geene tähistavad kapitali tähed, retsessiivne - liin. Must värvi geen domineerivad, nii et see tähistab A. Mehed punased värvainevill, retsessiivne - a. Järelikult on musta homosügootse pulli genotüüp AA. Mis on punase lehma genotüüp? Sellel on retsessiivne märk, mis võib ilmneda fenotüüpiliselt homosügüüsi seisundis (organism). Seega selle genotüübi aa. Kui lehma genotüüpis oli vähemalt üks domineeriv geen A, siis ta ei oleks punane villa. Nüüd, kui vanemate isikute genotüüpide määratakse kindlaks, on vaja koostada teoreetilise ületamise skeemi
Black Bull moodustab ühte tüüpi kaalu järgi vastavalt tõelisele - kõik suguelundite rakud sisaldavad ainult geeni A. Mugavuse huvides lugemise, kirjutame ainult liiki kaalud, mitte kõik seks rakud selle looma. Homosügootne lehm on ka üks tüüpi mänge - a. Selliste mängude ühendamisel üks, ainus võimalik genotüüp - AA, s.t. Kõik järglased on ühtlaselt ja kannavad märk vanem, kellel on domineeriv fenotüüp - must härja ..
Seega saate kirjutada järgmine vastus: homosügootse musta pulli ja punase lehma ületamisel järglastel peaksite ootama ainult musta heterosügootse vasikaid
Järgmised ülesanded tuleks iseseisvalt lahendada, kirjeldades üksikasjalikult lahenduse kulgu ja valmistada täielikku vastust.
Ülesanne # 2. Millist järglasi saab oodata lehma ja pulli ületamisest, heterosügootse villa maalimisest?
Ülesanne # 3. merisigades määratakse taglasvill domineeriva genoomi poolt ja sile - retsessiivne.
1. Kahe pöördepiiri ületamine omavahel andsid 39 inimest, kellel on Vortex villa ja 11 siledat juukselooma. Mitu üksikisikute domineeriva fenotüübi peaks olema sellel alusel homosügoogilised?
2. Guide siga pöörleva villaga, kui ületate sujuva villaga isikuga inimesega, mis on esitatud järglastel 28 Vortexi ja 26 siledat juukse järeltulijat. Määrake vanemate ja järeltulijate genotüüpide.
Ülesanded di- ja polügibrid ületamise
Ülesande number 7. Kirjutage organismide galerid järgmiste genotüüpidega: AAVA; AABB; AAI; Aava; AAVR; AABB; AAV; AAVVSS; Aajss; AAVSS; Aavss
Me analüüsime ühte näidet. Selliste ülesannete lahendamisel on vaja juhinduda mängude puhtuse seadusest: Gameta geneetiliselt puhastatud, kuna iga alleelse paari iga üks geen langeb. Võtke näiteks isik Aavbssi genotüübiga. Alates esimesest geenidest - paari paari A - igas sugurakkudes langeb meioosi või geeni A või geeni a. Samu mänge paari geenide paari, mis asuvad teises kromosoomi, kantakse geen või B. Kolmas auru on ka igas sugurakkudes, mis varustab domineeriva geeni koos tema retsessiivse alleeliga - koos. Seega võib Gameta sisaldada kas kõiki domineerivaid geene - ABC või retsessiivne - ABC, samuti nende kombinatsioonid: ABC, ABC, ABE, ABC, ABC ja BS.
Selleks, et mitte eksida keha uuritud genotüübi moodustunud toetuste koguses, on võimalik kasutada valemiga N \u003d 2N, kus n on mängude liikide arv ja n on heterosügootse paari arv geenid. Selle valemi õigsuse korral on lihtne kontrollida näiteid: heterozygootaa'l on üks heterosügootne paar; Järelikult n \u003d 21 \u003d 2. See moodustab kaks klassi: a ja a. DIGETEROSIGOTAAVOAVO Sisaldab kahte heterosügootse paari: N \u003d 22 \u003d 4, neli tüüpi mänge on moodustatud: AB, AB, AB, AB. Trigenosigotaahavs vastavalt sellele peaksid moodustama 8 sortide suguelundite rakkude n \u003d 23 \u003d 8), need on juba tühjendatud eespool.
Ülesande number 8. Veiste puhul domineeritakse roosgeen kõrguse genoomi üle ja must mantel geen on üle punase värvi genoomi. Mõlemad geenide paari on erinevates kromosoomides.
1. Millised on vasikad, kui me ületasime heterosügootse mõlema paari
Bulli ja lehma märke?
2. Milliseid järglasi tuleks oodata mustade komoleku pulli ületamist, heterosügootset mõlema paari paari, punase sarvega lehmaga?
Täiendavad ülesanded laboratoorse töö jaoks
Ülesanne # 1. Belliferma juures saadi 225 Mart. Nendest 167 loomadel on pruun karusnahk ja 58 naaritsaga sinakas halli värvi. Määrake allika vormide genotüüpid, kui on teada, et pruuni värvi geen domineerib sinakashalli värvi määramisel genoomi.
Ülesanne # 2. Isikul on pruun silma silmade domineerib genoomi tõttu siniste silmade tõttu. Sinine silmadega mees, kellelegi vanematel oli pruunid silmad, abielus karbohülaasi naisega, kellel oli isa pruuniks silmad ja ema oli sinine. Millist järglasi saab oodata sellest abielust?
Ülesanne # 3. Albinism pärineb inimestel retsessiivse märgiga. Perekonnas, kus üks abikaasadest albiino ja teine \u200b\u200bon pigmenteeritud juuksed, on kaks last. Üks lapse albiino, teine \u200b\u200b- värvitud juuksed. Mis on tõenäosus sündi järgmise lapse-albiino?
Ülesande number 4. Koertel domineerib villa must värv kohvi ja lühikese villa - pikk. Mõlemad geenide paari on erinevates kromosoomides.
1. Millist musta lühikarvaliste kutsikate protsent võib oodata kahe inimese ületamisest, heterosügootse mõlemal põhjusel?
2. jahimees ostis musta koera lühikese villaga ja tahab olla kindel, et see ei kanna pikkade kohvilate geene. Mis partner fenotüübi ja genotüübi tuleks valida ristumiseks kontrollida genotüübi ostetud koera?
Ülesande number 5. Human, inimese silmade geen domineerib genoomi, mis määrab sinise silma maali ja geeni arengu määramise, mis põhjustab võime paremat paremat kätt, valitseb üle genoomi, mis määrab vasakukäelsuse arengut. Mõlemad geenide paari asub erinevates kromosoomides. Mis võiks olla lapsed, kui nende vanemad on heterosügootse?
Ülesande number 6. Isikul on retsessiivne geen ja tuvastab süütu kurtuse. Pärilik kurtide ja-loll mees abielus naisega, kellel on tavaline kuulujutt. Kas on võimalik kindlaks määrata lapse ema genotüüp?
Ülesande number 7. Kollane herneseemnest saadi taim, mis andis 215 seeme, millest 165 kollane ja 50 roheline. Millised on kõigi vormide genotüübid?
Ülesande number 8. Isa ja ema tundsid fenüültioomi mõru maitset. Kaks neljast last ei tunne selle ravimi maitset. Võttes arvesse tundlikkuse erinevusi fenüültiomomo-sõltumatu monogeeni, määrata domineeriva või retsessiivse tundestamise fenüültiomomeetriini.