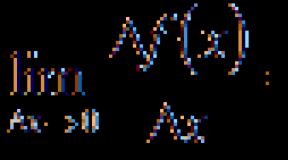Iz česa je sestavljena mlečna kislina? Kemijske in fizikalne lastnosti mlečne kisline
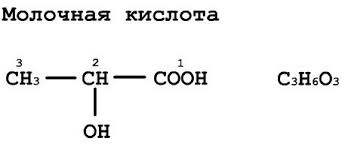
Mlečna kislina (laktat) - α-hidroksipropionska (2-hidroksipropanojska) kislina.
- t pl 25-26 ° C optično aktivna (+) - ali (-) - oblika.
- t pl 18 ° C racemična oblika.
- Kemična formula: CH 3 CH (OH) COOH
- Racemična formula: C 3 H 6 O 3
Mlečna kislina nastaja med mlečnokislinsko fermentacijo sladkorjev, zlasti v kislem mleku, med fermentacijo vina in piva. Uporablja se v kemični in živilski industriji kot konzervans. V človeškem telesu med razgradnjo glukoze nastane mlečna kislina (laktat).
Torej obstaja razlika med mlečno kislino in laktatom? Ne. V organski kemiji se mlečna kislina pogosteje imenuje, v biokemiji - laktat.
Laktat obdaja verjetno največ različnih mitov, ki večinoma ne ustrezajo resničnosti. In čeprav je v ruščini dovolj zanesljivih materialov o laktatu, številni amaterski športniki (in nekateri strokovnjaki) trmasto še naprej verjamejo in ponavljajo mite iz prejšnjega stoletja.
Na kratko in jedrnato povzemimo osnovna dejstva o laktatu.
Laktat se vedno tvori med proizvodnjo energije v telesu.
Glavna pot za oskrbo celic z energijo je razgradnja glukoze. Molekula glukoze opravi vrsto 10 zaporednih reakcij, da proizvede piruvat v procesu, imenovanem glikoliza. Nadalje se en del piruvata delno oksidira in pretvori v ogljikov dioksid in vodo. Drugi del se pretvori v laktat pod nadzorom encima laktat dehidrogenaze.
Ta reakcija je reverzibilna.
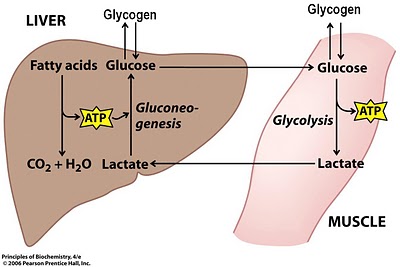
Nekaj \u200b\u200blaktata se uporablja za sintezo energije.
15 do 20 odstotkov celotnega laktata se med glukoneogenezo pretvori v glikogen.
Laktat je univerzalni nosilec energije.
V pogojih visoke proizvodnje energije v anaerobnem načinu je laktat nosilec energije od tistih krajev, kjer zaradi povečane kislosti ni mogoče transformirati energije do tistih krajev, kjer se lahko spremeni v energijo (srce, dihalne mišice, počasi krčenje mišična vlakna, druge mišične skupine).
Povišanje ravni laktata ni posledica pomanjkanja kisika.
Študije na živalih kažejo, da pomanjkanje znotrajceličnega kisika v izolirani mišici ne kaže nobenih omejitev v aktivnosti mitohondrijske dihalne verige niti med največjo vadbo. V mišicah bomo imeli vedno dovolj kisika.
Laktat je pokazatelj obremenitve anaerobne glikolize.
Vsakič, ko nastane piruvat, končni produkt presnove glukoze med glikolizo, nastane laktat. Laktat se kopiči preprosto zato, ker je stopnja preoblikovanja energije med anaerobno in aerobno vadbo drugačna.
Večja je delovna intenzivnost, več laktata se tvori.
Raven laktata v krvi je tesno povezana z intenzivnostjo vadbe. Laktat se kopiči zaradi razlike v hitrosti preobrazbe energije pri anaerobni in aerobni vadbi. Hitrost preoblikovanja energije pri anaerobni presnovi energije je hitrejša kot pri aerobni presnovi.
Laktat ne ustvarja kislosti, ampak ga spremlja.
S proizvodnjo energije hkrati proizvajamo kislost. Energijske reakcije v našem telesu potekajo s sodelovanjem elektronov kot nosilcev energije. Produkta glukolize sta laktat in vodikov protonski H +. Ukrep aktivnosti (koncentracija) vodikovih ionov (H +) v raztopini izraža njegovo kislost.
Laktat le začasno vzame kislo sredstvo (H +) za izvedbo reakcije in ga nato vrne v nevtralno okolje.
Telo v prvi uri po vadbi porabi 90% laktata.
60% laktata v telesu je popolnoma oksidirano v CO2 in vodo. Približno 20% se v procesu glukoneogeneze pretvori v glikogen, del se uporablja za tvorbo aminokislin. Le majhen del (manj kot 5%) laktata se izloči z znojem in urinom.
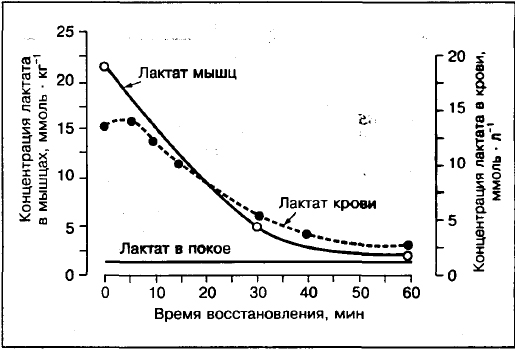
Laktat v krvi ne bo sistematično odražal prisotnosti laktata v mišicah.
Primerjave koncentracije laktata v mišicah in krvi kažejo, da če napor preseže 75-80% VO2max, je koncentracija laktata v mišicah (biopsija mišic sprednjega dela stegna) večja kot v krvi. V nasprotju z aktivnostmi z zmerno intenzivnostjo 30%, 50%, 70% VO2max, kjer je koncentracija laktata v arterijska kri višje kot v mišicah.
Laktat ne povzroča bolečin v mišicah ali krčev.
Bolečine v mišicah dan po intenzivnem treningu povzročajo poškodbe mišic in vnetje tkiva, ki se pojavi po vadbi. Večino mišičnih krčev povzročajo živčni receptorji v mišicah, ki se preveč utrudijo v mišicah.
Na podlagi gradiva cmtscience.com (2016).
Hidroksi kisline (alkoholne kisline) so derivati \u200b\u200bkarboksilnih kislin, ki vsebujejo eno, dve ali več hidroksilnih skupin v radikalu, vezanem na karboksil.
Odvisno od števila karboksilnih skupin se oksikisline delijo na monobazne, dvobazne itd .; odvisno od skupnega števila hidroksilnih skupin se oksikisline delijo na mono- ali polihidrične.
Glede na naravo radikala so hidroksi kisline nasičene in nenasičene, aciklične, ciklične ali aromatske.
V hidroksi kislinah najdemo naslednje vrste izomerije:
strukturni(izomerija radikalne verige, izomerija medsebojnega položaja karboksila in hidroksila);
optični(zrcalni) zaradi prisotnosti asimetričnih atomov ogljika.
Oksiacidi so poimenovani po kislini z dodatkom "hidroksi" ali "dioksi" itd. Tudi trivialna nomenklatura se pogosto uporablja.
HO - CH 2 –COOH
glikolni (oksiocetni)
mlečni (α-hidroksipropionski)
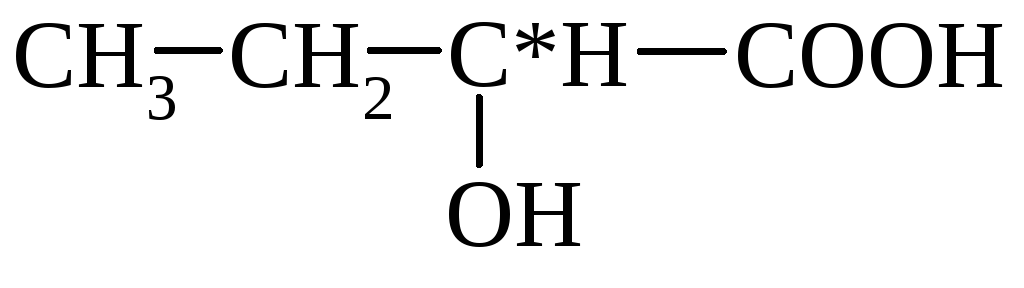
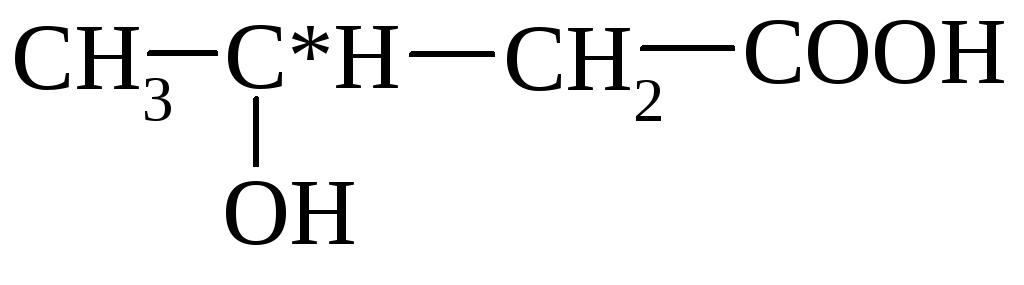
α-hidroksi-maslena β-hidroksi-maslena
(2-hidroksibutan) (3-hidroksibutan)
Fizične lastnosti.Spodnje hidroksi kisline so najpogosteje goste, sirupaste snovi. Oksiacidi se mešajo z vodo v katerem koli razmerju in s povečanjem molekulske mase se topnost zmanjša.
Kemijske lastnosti.
1. Kisle lastnosti - hidroksi kisline dajejo vse reakcije, značilne za karboksil: tvorba soli, estrov, amidov, halogenidov itd. Hidroksi kisline so močnejši elektroliti kot ustrezne karboksilne kisline (učinek hidroksilne skupine).
2. Alkoholne lastnosti - reakcije vodikove substitucije hidroksi skupine, tvorba etrov in estrov, substitucija –OH s halogenom, intramolekularna dehidracija, oksidacija.
kloroocetni glikolni glioksalni
kisla kislina kislina
a) HO - CH 2 –COOH + CH 3 OH HO - CH 2 –CO - O - CH 3 + H 2 O
ester glikolne kisline in metilnega alkohola
b) HO - CH 2 –COOH + 2CH 3 OHCH 3 –O - CH 2 –COOCH 3 + 2H 2 O
glikolni metil metil eter
kisli alkohol metoksiacetna kislina
(celotna oddaja)
3. Razmerje med hidroksi kislinami in ogrevanjem - pri segrevanju se α-hidroksi kisline odcepijo od vode in tvorijo ciklični ester, ki ga tvorita dve molekuli α-hidroksi kislin:
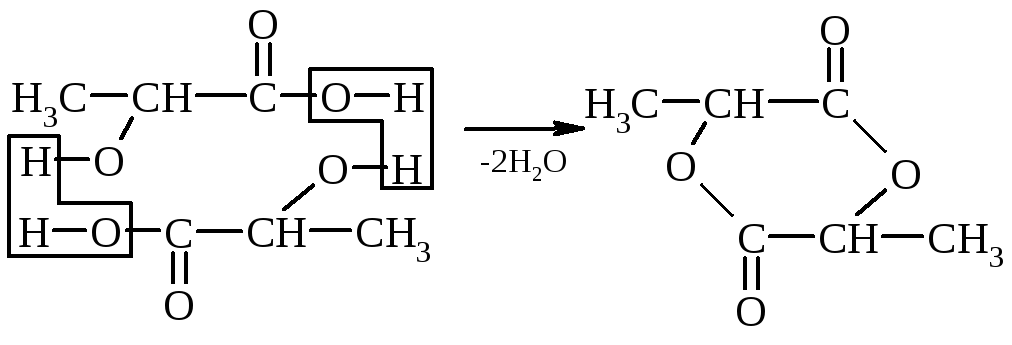
a-hidroksipropionska kislina laktid
β-hidroksi kisline v enakih pogojih zlahka izgubijo vodo in tvorijo nenasičene kisline.
HO - CH 2 –CH 2 –COOH 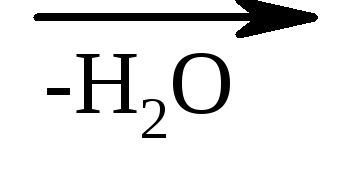 CH 2 \u003d CH - COOH
CH 2 \u003d CH - COOH
β-hidroksipropionska akrilna kislina
γ-hidroksi kisline lahko izgubijo tudi molekulo vode s tvorbo intramolekularnih estrov - laktonov.
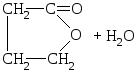
HO - CH 2 –CH 2 –CH 2 –COOH
γ-hidroksimaslena kislina
γ-butirolakton
Nekatere hidroksi kisline izvirajo iz naravnih izdelkov. Tako mlečno kislino dobimo z mlečnokislinsko fermentacijo sladkih snovi. Sintetične proizvodne metode temeljijo na naslednjih reakcijah:
1) Cl - СН 2 –СООН + НОН 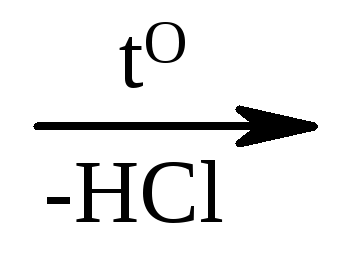 HO - CH 2 –COOH;
HO - CH 2 –COOH;
monokloroocetni glikol
kisla kislina
2) CH2 \u003d CH - COOH + NOH 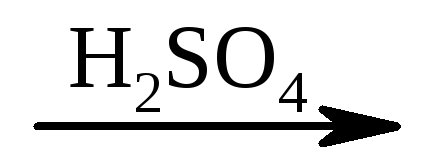 HO - CH 2 –CH 2 –COOH.
HO - CH 2 –CH 2 –COOH.
akrilna kislina β-hidroksipropionska kislina
Predstavniki hidroksi kislin.
Glikolni (hidroksiocetna) kislina je kristalinična snov, ki jo najdemo v nezrelem sadju, pesnem soku, repi in drugih rastlinah. V industriji se pridobiva z redukcijo oksalne kisline. Uporablja se za barvanje (silikonski tisk).
Mlečna kislina (α-hidroksipropionska) je gosta tekoča ali kristalinična masa z nizkim tališčem. Mlečna kislina nastaja med mlečnokislinsko fermentacijo sladkorjev pod delovanjem mlečnokislinskih bakterij. Vsebovano v fermentiranih mlečnih izdelkih, kislem zelju, silaži. Uporablja se pri barvanju mordant, v usnjarski industriji, v medicini.
Meso in mlečna kislina najdemo v živalskih mišičnih sokih in mesnih izvlečkih.
Dvoatomni glicerinska kislina sodeluje v življenjskih procesih rastlin in živali.
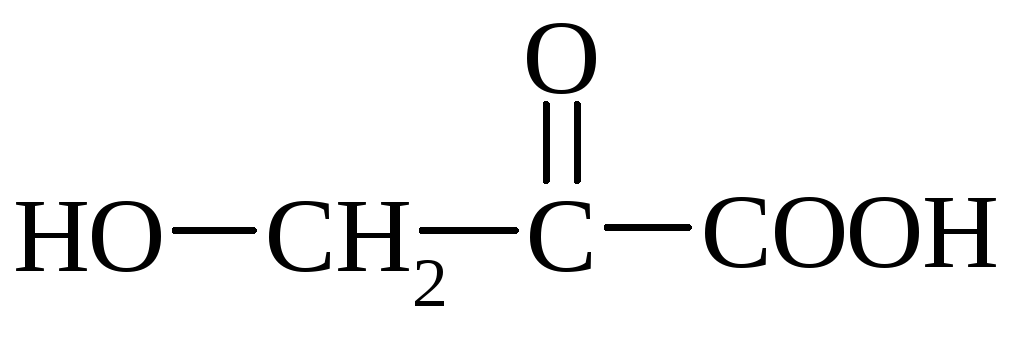
Vitamin C (vitamin C) - kristalna snov, ki jo najdemo v svežem sadju, limonah, črnem ribezu, sveža zelenjava - zelje, fižol. Vitamin C je sintetično pridobljen z oksidacijo polihidričnega alkohola sorbitola.
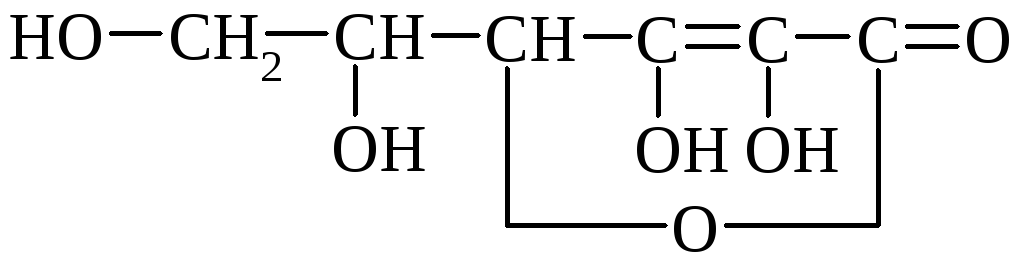 α-askorbinska kislina
α-askorbinska kislina
Askorbinska kislina se zlahka razgradi v atmosferskem kisiku, zlasti pri segrevanju
Aciklični dve- in tribazne hidroksi kisline.
Apple (hidroksi jantarna) kislina (HOOC - CHOH - CH 2 –COOH) je kristalinična snov, dobro topna v vodi; uporablja se v medicini, vsebuje ga nezrel gorski pepel, barberry, rabarbara, grozdni sok, vino.
Vino (vinska, dioksisukcinska) kislina (HOOC– * CHOH– * CHOH - COOH) ima 2 asimetrična atoma ogljika in ima zato 4 optične izomere. Tvori kisle kalijeve soli, ki so v vodi slabo topne in oborine. Kristale soli lahko opazimo v vinu (vinski kamen). Mešana kalijevo-natrijeva sol se imenuje Rochellejeva sol. Soli vinske kisline se imenujejo tartarati.
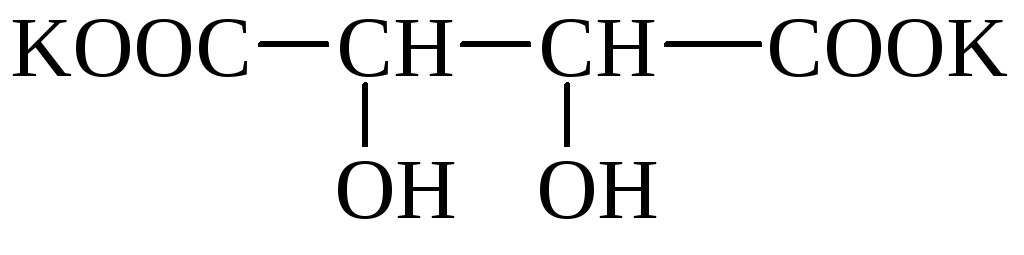
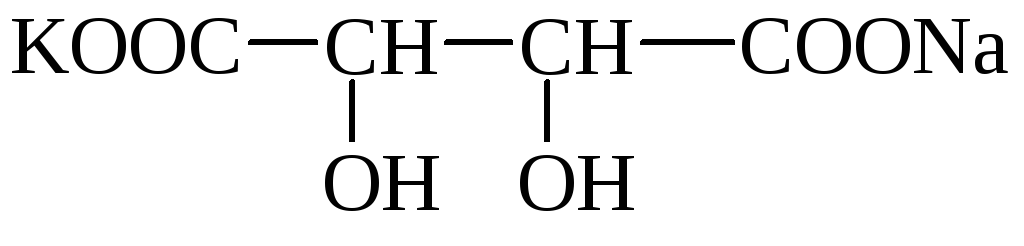
vinski kamen Rochelle
Vinska kislina je pogosta v rastlinah (gorski pepel, grozdje itd.).
Limonska kislina
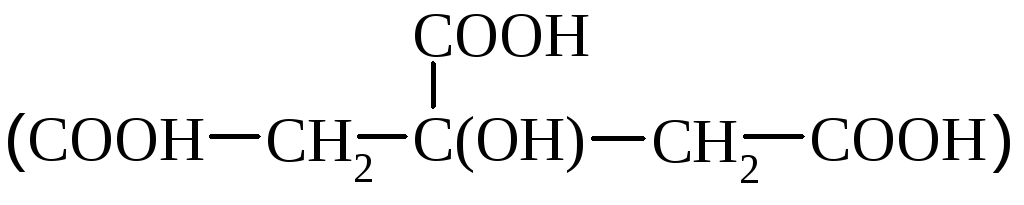 najdemo v agrumih. V industriji ga pridobivajo iz plodov limone, z oksidacijo sladkorjev s plesnimi, s predelavo smrekovih iglic.
najdemo v agrumih. V industriji ga pridobivajo iz plodov limone, z oksidacijo sladkorjev s plesnimi, s predelavo smrekovih iglic.
Citronska kislina je biološko pomembna spojina, ki sodeluje pri presnovi. Uporablja se v medicini, živilski, tekstilni industriji kot dodatek barvilom.
Ciklične monobazne polihidrične hidroksi kisline so del žolčnih kislin in drugih fiziološko pomembnih spojin; na primer, auksin poveča rast rastlin.
Aromatske hidroksi kislineso razdeljeni na fenolne kisline in maščobno-aromatske kisline, ki vsebujejo hidroksil v stranski verigi.
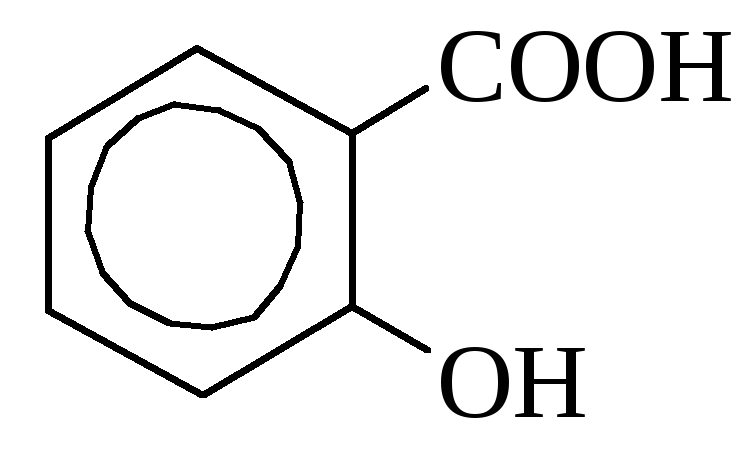
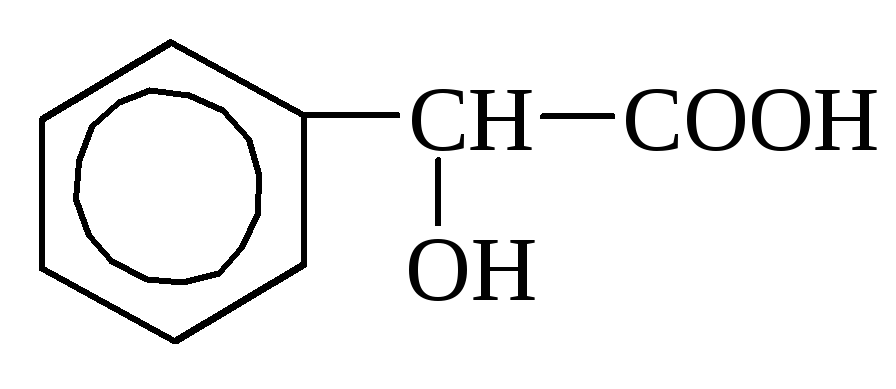
o-hidroksibenzojska mandljeva kislina
(salicilna kislina
Salicilna kislina najdemo ga v nekaterih rastlinah v prosti obliki (ognjič), vendar pogosteje v obliki estrov. V industriji se pridobiva s segrevanjem natrijevega fenolata z ogljikovim dioksidom. Uporablja se kot razkužilo in pri sintezi barvil. Številni derivati \u200b\u200bsalicilne kisline se uporabljajo kot zdravila (aspirin, salol).
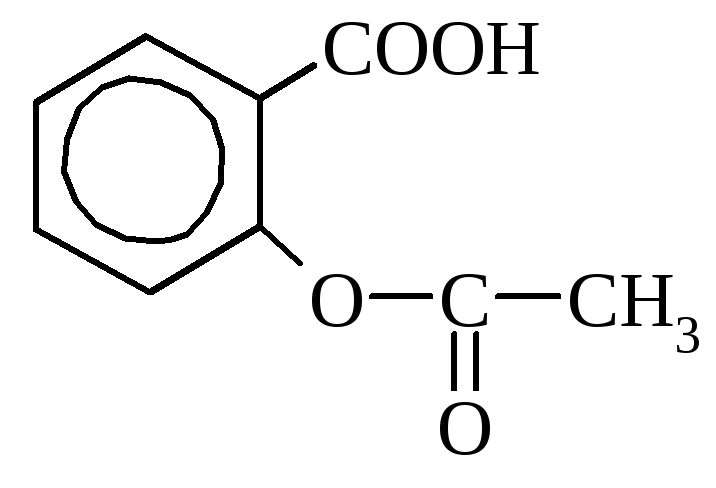
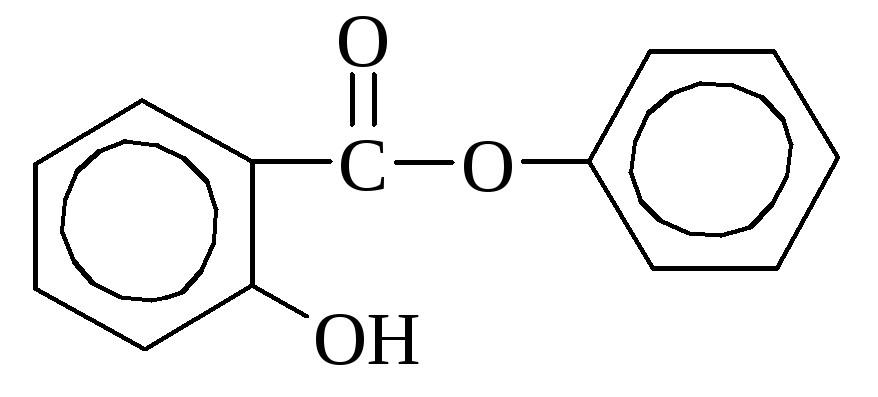
aspirin salol (fenilni eter
(acetilsalicilna kislina) salicilna kislina)
Galska kislina (3,4,5-trioksibenzojska kislina).
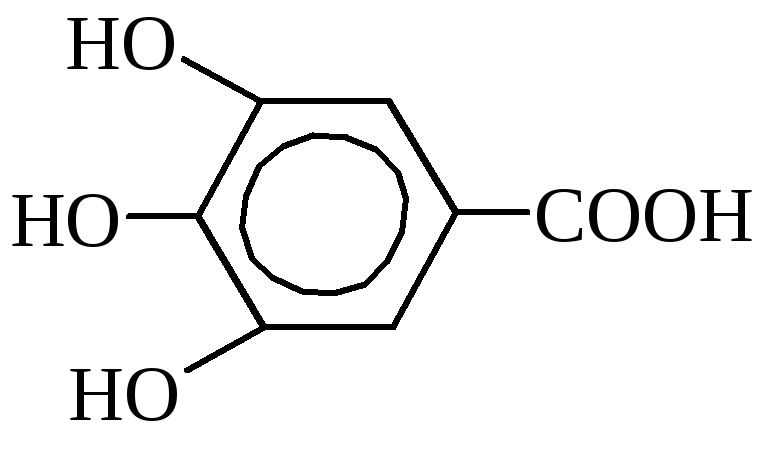
Vsebovano v čajnih listih, hrastovem lubju, granatnem drevesu. V industriji ga pridobivajo iz tanina s kuhanjem z razredčenimi kislinami. Uporablja se za izdelavo črnila, v fotografiji in v medicini kot antiseptik. Galska kislina in njeni derivati \u200b\u200bse pogosto uporabljajo kot konzervansi za številne prehrambene izdelke (maščobe, visokokakovostna mila, mlečni izdelki), imajo strojenje in so določenega pomena pri proizvodnji usnja in barvanju mordant.
Mandljeva kislina se nanaša na maščobne aromatske kisline (C 6 H 5 –CH (OH) –COOH), vsebuje ga amigdalin, gorčica, bezeg itd.
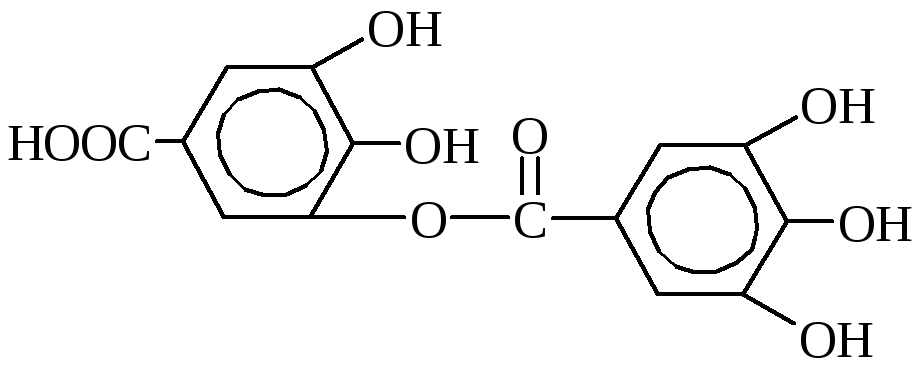
Tanini so pogosto derivati \u200b\u200bpolihidričnih fenolov. Najdemo jih v rastlinah, pridobivajo pa jih iz izvlečkov lubja, lesa, listov, korenin, plodov ali rastlin (žlebov).
Tanini so najpomembnejši tanini. Gre za mešanico različnih kemičnih spojin, med katerimi so glavni estri galne in digalne kisline ter glukoze ali polihidričnih alkoholov.
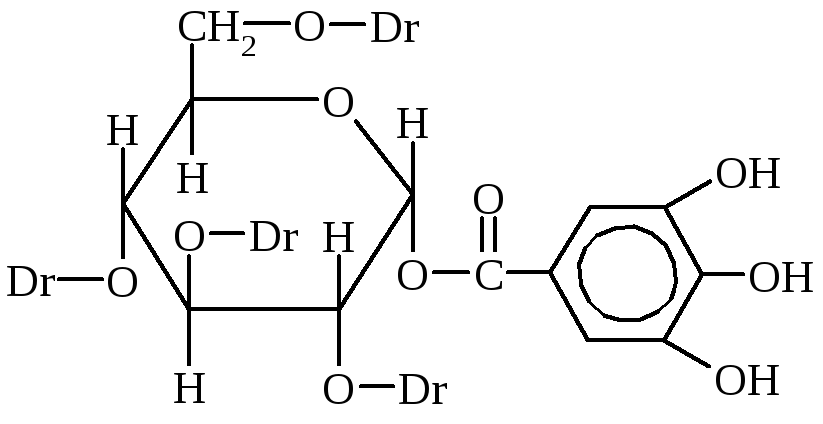
Dg-digalna kislina
m-digalna kislina
Tanin ima fenolne in estrske lastnosti. Tvori črno kompleksno spojino z raztopino železovega klorida. Tanini se pogosto uporabljajo kot izvlečki za strojenje, žleze za barvanje bombažnih tkanin, kot veziva v medicini (imajo baktericidne, hemostatske lastnosti) in so konzervansi.
Lipidi vključujejo organske snovi, med katerimi so mnogi estri maščobnih kislin z visoko molekulsko maso in polihidrični alkoholi, kot so maščobe, fosfatidi, voski, steroidi, maščobne kisline z visoko molekulsko maso itd.
Lipide najdemo predvsem v rastlinskih semenih, jedrcih oreščkov in v živalskih organizmih - v maščobnih in živčnih tkivih, zlasti v možganih živali in ljudi.
Naravne maščobe so mešanice trihidričnih alkoholnih estrov glicerola in višjih karboksilnih kislin, tj. mešanice gliceridov teh kislin.
O 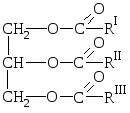 splošna formula maščobe:
splošna formula maščobe:
kjer so R I R II R III ogljikovodikovi radikali višjih maščobnih kislin normalne strukture s sodo številom ogljikovih atomov. Sestava maščob lahko vključuje ostanke nasičenih in nenasičenih kislin.
Nasičene kisline:
С 15 H 31 COOH - palmitic;
C 17 H 35 COOH - stearinska;
C 3 H 7 COOH - olje (vsebovano v maslu) itd.
Nenasičene kisline:
C 17 H 33 COOH - oleinska;
С 17 Н 31 COOH - linolna;
C 17 H 29 COOH - linolenska itd.
Maščobe so pridobljene iz naravnih virov živalskega in rastlinskega izvora.
Fizične lastnostimaščobe so posledica kisle sestave. Maščobe, ki vsebujejo predvsem ostanke nasičenih kislin, so trdne ali mastne snovi (ovčetina, goveja maščoba itd.) Maščobe, ki vsebujejo predvsem ostanke nenasičenih kislin, imajo pri sobni temperaturi tekočo konsistenco in se imenujejo olja. Maščobe se ne raztopijo v vodi, se pa dobro raztopijo v organskih topilih: etru, benzenu, kloroformu itd.
Kemijske lastnosti.Kot vsi estri se tudi maščobe hidrolizirajo. Hidroliza lahko poteka v kislih, nevtralnih ali alkalnih medijih.
1. Hidroliza kisline.
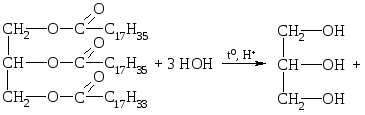
Mlečna kislina
MLEČNA KISLINA (2-hidroksipropionska kislina) CH 3 CH (OH) COOH, mol. m 90,1; brezbarven kristali. Znano D (+) - mleko do - tega, D (-) - mleko (meso in mleko) do - tega in racemično. Mlečna kislina - mlečna do - ta fermentacija. Za tališče D, L- in D-mlečne kisline po 18 ° C in 53 ° C; t. kip. po 85 ° C / 1 mm Hg in 103 ° C / 2 mm Hg; za D-mlečno kislino [a] D 20 -2,26 (koncentracija 1,24% v vodi). Za D, L-mlečna kislina DH 0 - 682,45 kJ / mol; DH 0 pl 11,35 kJ / mol; DH isp 110,95kJ / mol (25 ° C), 65,73 kJ / mol (150 ° C). Za zgorevanje L-mlečne kisline DH 0 - 1344,8 kJ / mol; DH 0 obp -694,54 kJ / mol; DH 0 pl 16,87 kJ / mol.
Zaradi visoke higroskopnosti mlečne kisline se običajno uporablja njen koncentrator. vodne raztopine - sirupu podobne brezbarvne. tekočine brez vonja. Za vodne raztopine mlečne kisline d 20 4 1.0959 (40%), 1.1883 (80%), 1.2246 (100%); n D 25 1,3718 (37,3%), 1,4244 (88,6%); h 3,09 in 28,5 mPa. s (25 0 C) oz. za 45,48 in 85,32% raztopine; g 46,0. 10 -3 N / m (25 ° C) za 1 M raztopino; e 22 (17 ° C). Sol mlečne kisline. v vodi, etanolu, slabo v benzenu, kloroformu in drugih halogeniranih ogljikovodikih; pK a 3.862 (25 ° C); pH vodnih raztopin 1,23 (37,3%), 0,2 (84,0%).
Oksidacijo mlečne kisline običajno spremlja razgradnja. Pod vplivom zraka HNO 3 ali O 2 v prisotnosti. Cu ali Fe tvorijo HCOOH, CH 3 COOH, (COOH) 2, CH 3 CHO, CO 2 in piruvična kislina. Obnova mlečne kisline HI vodi do propionske kisline in okrevanje je prisotno. Ponovno mobilni - na propilen glikol.
Mlečna kislina pri segrevanju dehidrira v akril do vas. s HBr tvori 2-bromopropionsko do - tisto, pri interakciji. Ca-soli s PCl 5 ali SOCl 2 -2-kloropropionil kloridom. V prisotnosti. rudar. do-t samoestrifikacija mlečne kisline se pojavi s tvorbo laktona f-ly I, pa tudi linearnih poliestrov. Pri interakciji. mlečne kisline z alkoholi nastajajo hidroksi kisline RCH 2 CH (OH) COOH in med interakcijo. soli mlečne kisline salkoholni estri. Imenujejo se soli in estri mlečne kisline. laktati (glej tabelo).
Posledično nastane mlečna kislina mlečnokislinska fermentacija (pri kisanju mleka, kisanju zelja, kisanju zelenjave, zorenju sira, siliranju krme); D-mlečna kislina se nahaja v tkivih živali, rastlin in tudi v mikroorganizmih.
V prom-sti mlečno kislino dobimo s hidrolizo 2-kloropropionske kisline in njenih soli (100 ° C) ali laktonitrila CH 3 CH (OH) CN (100 ° C, H 2 SO 4), čemur sledi. tvorba estrov, katerih izolacija in hidroliza vodi do visokokakovostnega izdelka. Obstajajo tudi druge znane metode za pridobivanje mlečne kisline: oksidacija propilena z dušikovimi oksidi (15-20 ° C), čemur sledi. obdelava H 2 SO 4, interakcija. CH3CHO s CO (200 ° C, 20 MPa).
LASTNOSTI NEKATERIH LAKATOV
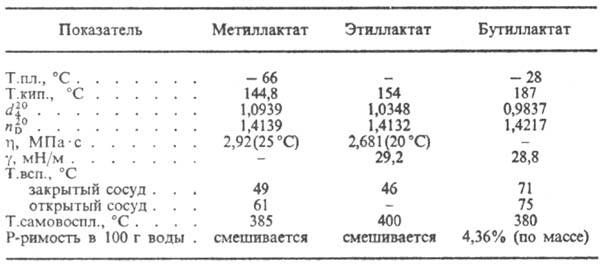
M mlečna kislina se uporablja v hrani. industriji, v barvanju mortant, v usnjarstvu, v fermentacijskih trgovinah kot baktericidno gojišče za pridobivanje leka. Poroka, mehčalci. Etilni in butil laktati se uporabljajo kot topila celuloznih etrov, sušilnih olj, raste. olja; butil laktata, pa tudi raztopino nekaterih sintetičnih. polimeri.
Mlečna kislina (2-hidroksipropionska kislina) CH 3 CH (OH) COOH, molekulska masa 90,1; brezbarven. Znani L (+) - mlečna kislina, D (-) - mlečna (mesno-mlečna) kislina in racemska mlečno-kislo-mlečnokislinska fermentacija. Za D, L- in D-mlečno kislino tališče ustreza 18 ° C in 53 ° C; t. kip. po 85 ° C / 1 mm Hg in 103 ° C / 2 mm Hg; za D-mlečno kislino [α] D 20 -2,26 (koncentracija 1,24% in. Za D, L-mlečna kislina D H 0 vzorec - 682,45 kJ / mol; D H 0 pl 11,35 kJ / mol; D H isp 110,95 kJ / mol (25 ° C), 65,73 kJ / mol (150 ° C). Za L-mlečno kislino D H 0 zgorevanje - 1344,8 kJ / mol; D H 0 vp -694,54 kJ / mol; D H 0 pl 16,87 kJ / mol.
Zaradi visoke higroskopnosti mlečne kisline se običajno uporabljajo njene koncentrirane vodne raztopine - sirupaste, brezbarvne, brez vonja. Za vodne raztopine mlečna kislina d 20 4 1,0959 (40%), 1,1883 (80%), 1,2246 (100%); n D 25 1,3718 (37,3%), 1,4244 (88,6%); h 3,09 in 28,5 mPa. s (25 0 C) oz. za 45,48 in 85,32% raztopine; g 46,0. 10 -3 N / m (25 ° C) za 1 M raztopino; e 22 (17 ° C). Mlečna kislina je topna v, slabo vgrajenih in drugih halogeniranih ogljikovodikih; R K a 3,862 (25 ° C); pH vodnih raztopin 1,23 (37,3%), 0,2 (84,0%).
Mlečna kislina dehidrira v akrilno kislino, ko pri segrevanju s HBr tvori 2-bromopropionsko kislino, ko sol Ca reagira s PCl 5 ali SOCl 2 -2-kloropropionil kloridom. V prisotnosti mineralnih kislin pride do samoestrifikacije mlečne kisline s tvorbo formule I, pa tudi linearnih poliestrov. Pri interakciji mlečne kisline nastanejo hidroksi kisline RCH 2 CH (OH) COOH, pri interakciji mlečne kisline z alkoholi pa estri. Soli in estri mlečne kisline se imenujejo laktati (glej tabelo).
mlečna kislina nastane kot posledica mlečne kisline (pri kisanju mleka, kislega zelja, kisanju zelenjave, zorenju sira, siliranju krme); D-mlečna kislina se nahaja v tkivih živali, rastlin in tudi v mikroorganizmih.
V industriji se iz mlečne kisline pridobi 2-kloropropionska kislina in njen (100 ° C) ali laktonitril CH 3 CH (OH) CN (100 ° C, H 2 SO 4), čemur sledi tvorba estrov, izolacija in hidroliza kar vodi do visokokakovostnega izdelka. Znane so tudi druge metode pridobivanja mlečne kisline: oksidacija propilena z dušikovimi oksidi (15-20 ° C), čemur sledi obdelava s H2SO4, interakcija CH3CHO s CO (200 ° C, 20 MPa).
LASTNOSTI NEKATERIH LAKATOV

mlečna kislina se uporablja v prehrambeni industriji, barvanju preliv, proizvodnji usnja, fermentacijah kot baktericidno sredstvo za pridobivanje zdravila, mehčala. Etilni in butil laktati se uporabljajo kot topila celuloznih etrov, sušilnih olj, rastlinskih olj; butil laktat - kot tudi topilo za nekatere sintetične polimere.
Svetovna proizvodnja mlečne kisline 40 tisoč ton (1983).
Lit.:Holten C.H., mlečna kislina. Lastnosti in kemija. Mlečna kislina in njeni derivati, Weisheim, 1971. Yu.A. Treger.
Izberite prvo črko v naslovu članka:
Kataloška številka mlečne kisline: CAS 50-21-5
Opis mlečne kisline:
Skoraj prozorna, rahlo rumenkasta higroskopna sirupna tekočina rahlo kislega vonja, ki spominja na jogurt. Topen je v vodi, etanolu, slabo v benzenu, kloroformu in drugih halogeniranih ogljikovodikih. Obstajajo različni optično aktivni izomeri oblike D in L. In tudi optično neaktivna zmes D in L. Slednjo dobimo s kemično sintezo, aktivne oblike pa z bakterijami. (encimska metoda) V človeškem telesu je optično aktivna oblika L tista, ki sodeluje v Krepsovem ciklusu, zato jo je priporočljivo uporabljati kot dodatek (mlečna kislina, E270), v drugih panogah pa to ne deluje posebno vlogo.
Globalno ime Mlečna kislina se v Rusiji ni ukoreninilo, toda ime njenih laktatnih soli najdemo povsod, veliko pogosteje kot kalcijeva mlečna kislina kalcij laktat.
Specifikacija mlečne kisline 80%.
Vrelišče (100% raztopina) 122 ° C (115 mm Hg)
Specifična teža (20 ° C) 1.22
Topnost v vodi Popolnoma topna
Gostota (pri 20 ° C) 1,18-1,20 g / ml
Težke kovine, ne več kot 0,001%
Vsebnost železa, ne več kot 0,001%
Vsebnost arzena, ne več kot 0,0001%
Vsebnost klorida, ne več kot 0,002% (dejansko 0,0015%)
Vsebnost sulfata, ne več kot 0,01% (dejansko 0,004%)
Ostanki po žganju ne več kot 0,1% (dejansko 0,06%)
Proizvajalec: Kitajska
Pakiranje: sodi 25 kg ali kocke 1200 kg
Glavne fizikalne lastnosti mlečne kisline:
Tališče: 17 ° C Za optično neaktivne (racemične)
Optično aktivna + ali - oblika 25-26 ° C
(razlike v temperaturah taljenja omogočajo kakovostno in hitro ločevanje dražjih optično aktivnih oblik od cenejših neaktivnih !!)
Relativna gostota (voda \u003d 1): 1.2
Topnost v vodi: meša se
Molekulska masa: 90,08 g / mol
Plamenišče: 110 ° C c.c.
Porazdelitveni koeficient oktanol / voda kot log Pow: -0,6
Nevarnost eksplozije in požara:
Podpira izgorevanje v normalnih pogojih. samozgaranje ni verjetnoNe dovolite, da bi kadil odprti ogenj.
Zatiranje požara: prah, pena, odporna na alkohol, vodni razpršilec,
ogljikov dioksid.
Kemijska stabilnost: Stabilno ob normalne temperature in pritisk.
Pogoji, ki se jim je treba izogniti: Nastajanje prahu, prekomerna vročina.
Nezdružljivost z drugimi materiali:Močni oksidanti, mineralne kisline.
Nevarni produkti razgradnje: Dušikovi oksidi, ogljikov monoksid, ogljikov dioksid, pari
cianid.
Nevarna polimerizacija: Ni preverjeno.
Nevarnost za ljudi:
Poti vstopa v telo:Snov se lahko absorbira v telo z vdihavanjem aerosola in zaužitjem.
Pri kratkotrajni izpostavljenosti koncentracijam, ki presegajo mejno koncentracijo pliko: Snov draži kožo in dihalne potiin ima tudi jedko
učinek na oči. Jedko pri zaužitju.
V primeru stika z očmi: Pordelost. Bolečina. Hude globoke opekline. Zaščitna očala, oz
zaščitna maska. Najprej večkrat sperite z veliko vode
minut (odstranite kontaktne lečeče ni težko), se odpeljite k zdravniku.
Standardi delovnega območja:
TLV (mejna vrednost praga, ZDA) ni določena.
Rakotvornost: Ni na seznamu ACGIH, IARC, NTP ali CA Prop 65.
Epidemiologija: Ni informacij.
Tetratogenost: Ni informacij.
Reproduktivni učinki:Ni informacij.
Mutagenost: ni informacij
Nevrotoksičnost: Ni informacij.
Poskusi na živalih so pokazali:
LD50 / LC50:
Draize test, zajec, oči: 100 mg hudo;
Draize test, zajec, koža: 500 mg / 24H blago;
Vdihavanje, podgana: LC50 \u003d\u003e 26 mg / m (kocka) / 1H;
Peroralno, miši: LD50 \u003d 1940 mg / kg;
Peroralno, podgana: LD50 \u003d 1700 mg / kg;
Koža, zajec: LD50 \u003d\u003e 10 gm / kg;
Pozor. Podani so podatki o koncentratu snovi, v majhnih količinah in koncentracijah mlečne kisline, glede na trenutno razpoložljive podatke je neškodljiv!